Белки: Третичная структура белков. Большая энциклопедия нефти и газа
МОДУЛЬ 1 СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ БЕЛКОВ
МОДУЛЬ 1 СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ БЕЛКОВ
Структура модуля | Темы |
Модульная единица 1 | 1.1. Структурная организация белков. Этапы формирования нативной конформации белков 1.2. Основы функционирования белков. Лекарства как лиганды, влияющие на функцию белков 1.3. Денатурация белков и возможность их спонтанной ренативации |
Модульная единица 2 | 1.4. Особенности строения и функционирования олигомерных белков на примере гемоглобина 1.5. Поддержание нативной конформации белков в условиях клетки 1.6. Многообразие белков. Семейства белков на примере иммуноглобулинов 1.7. Физико-химические свойства белков и методы их разделения |
Модульная единица 1 СТРУКТУРНАЯ ОРГАНИЗАЦИЯ МОНОМЕРНЫХ БЕЛКОВ И ОСНОВЫ ИХ ФУНКЦИОНИРОВАНИЯ
Цели изучения Уметь:
1. Использовать знания об особенностях структуры белков и зависимости функций белков от их структуры для понимания механизмов развития наследственных и приобретенных протеинопатий.
2. Объяснять механизмы лечебного действия некоторых лекарств как лигандов, взаимодействующих с белками и изменяющих их активность.
3. Использовать знания о строении и конформационной лабильности белков для понимания их структурно-функциональной неустойчивости и склонности к денатурации в изменяющихся условиях.
4. Объяснять применение денатурирующих агентов в качестве средств для стерилизации медицинского материала и инструментов, а также в качестве антисептиков.
Знать:
1. Уровни структурной организации белков.
2. Значение первичной структуры белков, определяющей их структурное и функциональное многообразие.
3. Механизм формирования в белках активного центра и его специфическое взаимодействие с лигандом, лежащее в основе функционирования белков.
4. Примеры влияния экзогенных лигандов (лекарств, токсинов, ядов) на конформацию и функциональную активность белков.
5. Причины и следствия денатурации белков, факторы, вызывающие денатурацию.
6. Примеры использования денатурирующих факторов в медицине в качестве антисептиков и средств для стерилизации медицинских инструментов.
ТЕМА 1.1. СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ. ЭТАПЫ ФОРМИРОВАНИЯ НАТИВНОЙ
КОНФОРМАЦИИ БЕЛКОВ
Белки - это полимерные молекулы, мономерами которых являются всего 20 α-аминокислот. Набор и порядок соединения аминокислот в белке определяется строением генов в ДНК индивидумов. Каждый белок в соответствии с его специфической структурой выполняет свойственную ему функцию. Набор белков данного организма определяет его фенотипические особенности, а также наличие наследственных болезней или предрасположенность к их развитию.
1. Аминокислоты, входящие в состав белков. Пептидная связь. Белки - полимеры, построенные из мономеров - 20 α-аминокислот, общая формула которых
Аминокислоты различаются по строению, размерам, физико-химическим свойствам радикалов, присоединенных к α-углеродному атому. Функциональные группы аминокислот определяют особенности свойств разных α-аминокислот. Встречающиеся в α-аминокислотах радикалы можно разделить на несколько групп:
Пролин, в отличие от других 19 мономеров белков, не аминокислота, а иминокислота, радикал в пролине связан как с α-углеродным атомом, так и с иминогруппой
 Аминокислоты различаются по растворимости в воде.
Это связано со способностью радикалов взаимодействовать с водой (гидратироваться).
Аминокислоты различаются по растворимости в воде.
Это связано со способностью радикалов взаимодействовать с водой (гидратироваться).
К гидрофильным относятся радикалы, содержащие анионные, катионные и полярные незаряженные функциональные группы.
К гидрофобным относятся радикалы, содержащие метильные группы, алифатические цепи или циклы.
2. Пептидные связи соединяют аминокислоты в пептиды. При синтезе пептида α-карбоксильная группа одной аминокислоты взаимодействует с α-аминогруппой другой аминокислоты с образованием пептидной связи:
Белки представляют собой полипептиды, т.е. линейные полимеры α-аминокислот, соединенных пептидной связью (рис. 1.1.)
 Рис. 1.1. Термины, используемые при описании строения пептидов
Рис. 1.1. Термины, используемые при описании строения пептидов
Мономеры аминокислот, входящих в состав полипептидов, называются аминокислотными остатками. Цепь повторяющихся групп -NH-CH-CO - образует пептидный остов. Аминокислотный остаток, имеющий свободную α-аминогруппу, называется N-концевым, а имеющий свободную α-карбоксильную группу - С-концевым. Пептиды записывают и читают с N-конца к С-концу.
Пептидная связь, образуемая иминогруппой пролина, отличается от других пептидных связей: у атома азота пептидной группы отсутствует водород,
вместо него имеется связь с радикалом, в результате одна сторона цикла включается в пептидный остов:
 Пептиды
различаются аминокислотным составом, количеством аминокислот и порядком
соединения аминокислот, например, Сер-Ала-Глу-Гис и Гис-Глу-Ала-Сер -
два разных пептида.
Пептиды
различаются аминокислотным составом, количеством аминокислот и порядком
соединения аминокислот, например, Сер-Ала-Глу-Гис и Гис-Глу-Ала-Сер -
два разных пептида.
Пептидные связи очень прочные, и для их химического неферментативного гидролиза требуются жесткие условия: анализируемый белок гидролизуют в концентрированной соляной кислоте при температуре около 110° в течение 24 часов. В живой клетке пептидные связи могут разрываться с помощью протеолитических ферментов, называемых протеазами или пептидгидролазами.
3. Первичная структура белков. Аминокислотные остатки в пептидных цепях разных белков чередуются не случайным образом, а расположены в определенном порядке. Линейная последовательность или порядок чередования аминокислотных остатков в полипептидной цепи называется первичной структурой белка.
Первичная структура каждого индивидуального белка закодирована в молекуле ДНК (в участке, называемом геном) и реализуется в ходе транскрипции (переписывания информации на мРНК) и трансляции (синтез первичной структуры белка). Следовательно, первичная структура белков индивидуального человека - наследственно передаваемая от родителей детям информация, определяющая особенности строения белков данного организма, от которых зависит функция имеющихся белков (рис. 1.2.).
 Рис. 1.2. Взаимосвязь между генотипом и конформацией белков, синтезирующихся в организме индивидума
Рис. 1.2. Взаимосвязь между генотипом и конформацией белков, синтезирующихся в организме индивидума
Каждый из примерно 100 000 индивидуальных белков в организме человека имеет уникальную первичную структуру. В молекулах одного типа белка (например, альбумина) одинаковое чередование аминокислотных остатков, что отличает альбумин от любого другого индивидуального белка.
Последовательность аминокислотных остатков в пептидной цепи можно рассматривать как форму записи информации. Эта информация определяет пространственную укладку линейной пептидной цепи в более компактную трехмерную структуру, называемую конформацией белка. Процесс формирования функционально активной конформации белка носит название фолдинг.
4. Конформация белков. Свободное вращение в пептидном остове возможно между атомом азота пептидной группы и соседним α-углеродным атомом, а также между α-углеродным атомом и углеродом карбонильной группы. Вследствие взаимодействия функциональных групп аминокислотных остатков первичная структура белков может приобретать более сложные пространственные структуры. В глобулярных белках различают два основных уровня укладки конформации пептидных цепей: вторичную и третичную структуры.
Вторичная структура белков - это пространственная структура, формирующаяся в результате образования водородных связей между функциональными группами -С=О и - NH- пептидного остова. При этом пептидная цепь может приобретать регулярные структуры двух типов: α-спирали и β-структуры.
В α-спирали водородные связи образуются между атомом кислорода карбонильной группы и водородом амидного азота 4-й от него аминокислоты; боковые цепи аминокислотных остатков
располагаются по периферии спирали, не участвуя в образовании вторичной структуры (рис. 1.3.).
Объемные радикалы или радикалы, несущие одинаковые заряды, препятствуют формированию α-спирали. Остаток пролина, имеющий кольцевую структуру, прерывает α-спираль, так как из-за отсутствия водорода у атома азота в пептидной цепи невозможно образовать водородную связь. Связь между азотом и α-углеродным атомом входит в состав цикла пролина, поэтому пептидный остов в этом месте приобретает изгиб.
β-Структура формируется между линейными областями пептидного остова одной полипептидной цепи, образуя при этом складчатые структуры. Полипептидные цепи или их части могут формировать параллельные или антипараллельные β-структуры. В первом случае N- и С-концы взаимодействующих пептидных цепей совпадают, а во втором - имеют противоположное направление (рис. 1.4).
Рис. 1.3. Вторичная структура белка - α-спираль
 Рис. 1.4. Параллельные и антипараллельные β-складчатые структуры
Рис. 1.4. Параллельные и антипараллельные β-складчатые структуры
β-структуры обозначены широкими стрелками: А - Антипараллельная β-структура. Б - Параллельные β-складчатые структуры
В некоторых белках β-структуры могут формироваться за счет образования водородных связей между атомами пептидного остова разных полипептидных цепей.
В белках также встречаются области с нерегулярной вторичной структурой, к которым относят изгибы, петли, повороты полипептидного остова. Они часто располагаются в местах, где меняется направление пептидной цепи, например, при формировании параллельной β-складчатой структуры.
По наличию α-спиралей и β-структур глобулярные белки могут быть разделены на четыре категории.
Рис. 1.5. Вторичная структура миоглобина (А) и β-цепи гемоглобина (Б), содержащие восемь α-спиралей
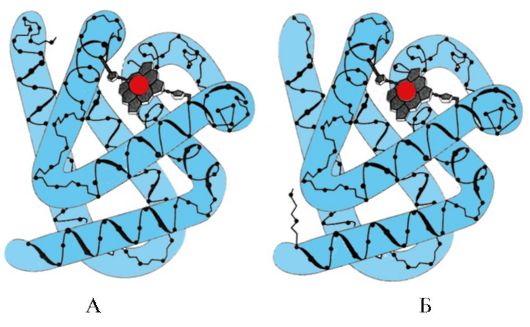
 Рис. 1.6. Вторичная структура триозофосфатизомеразы и домена пируваткиназы
Рис. 1.6. Вторичная структура триозофосфатизомеразы и домена пируваткиназы
 Рис. 1.7. Вторичная структура константного домена иммуноглобулина (А) и фермента супероксиддисмутазы (Б)
Рис. 1.7. Вторичная структура константного домена иммуноглобулина (А) и фермента супероксиддисмутазы (Б)
В четвертую категорию включены белки, имеющие в своем составе незначительное количество регулярных вторичных структур. К таким белкам можно отнести небольшие, богатые цистеином белки или металлопротеины.
Третичная структура белка - тип конформации, образующийся за счет взаимодействий между радикалами аминокислот, которые могут находиться на значительном расстоянии друг от друга в пептидной цепи. Большинство белков при этом формируют пространственную структуру, напоминающую глобулу (глобулярные белки).
Так как гидрофобные радикалы аминокислот имеют тенденцию к объединению с помощью так называемых гидрофобных взаимодействий и межмолекулярных ван-дер-ваальсовых сил, внутри белковой глобулы образуется плотное гидрофобное ядро. Гидрофильные ионизированные и неионизированные радикалы в основном располагаются на поверхности белка и определяют его растворимость в воде.
 Рис. 1.8. Типы связей, возникающих между радикалами аминокислот при формировании третичной структуры белка
Рис. 1.8. Типы связей, возникающих между радикалами аминокислот при формировании третичной структуры белка
1 - ионная связь - возникает между положительно и отрицательно заряженными функциональными группами;
2 - водородная связь - возникает между гидрофильной незаряженной и любой другой гидрофильной группой;
3 - гидрофобные взаимодействия - возникают между гидрофобными радикалами;
4 - дисульфидная связь - формируется за счет окисления SH-групп остатков цистеина и их взаимодействия друг с другом
Гидрофильные аминокислотные остатки, оказавшиеся внутри гидрофобного ядра, могут взаимодействовать друг с другом с помощью ионных и водородных связей (рис. 1.8).
Ионные и водородные связи, а также гидрофобные взаимодействия относятся к числу слабых: их энергия ненамного превышает энергию теплового движения молекул при комнатной температуре. Конформация белка поддерживается за счет возникновения множества таких слабых связей. Так как атомы, из которых состоит белок, находятся в постоянном движении, то возможен разрыв одних слабых связей и образование других, что приводит к небольшим перемещениям отдельных участков полипептидной цепи. Это свойство белков изменять конформацию в результате разрыва одних и образования других слабых связей называется конформационной лабильностью.
В организме человека функционируют системы, поддерживающие гомеостаз - постоянство внутренней среды в определенных допустимых для здорового организма пределах. В условиях гомеостаза небольшие изменения конформации не нарушают общую структуру и функцию белков. Функционально активная конформация белка называется нативной конформацией. Изменение внутренней среды (например, концентрации глюкозы, ионов Са, протонов и т.д.) приводит к изменению конформации и нарушению функций белков.
Третичная структура некоторых белков стабилизирована дисульфидными связями, образующимися за счет взаимодействия -SH групп двух остатков
 Рис. 1.9. Образование дисульфидной связи в молекуле белка
Рис. 1.9. Образование дисульфидной связи в молекуле белка
цистеина (рис. 1.9). Большинство внутриклеточных белков не имеет в третичной структуре ковалентных дисульфидных связей. Их наличие характерно для секретируемых клеткой белков, что обеспечивает их большую стабильность во внеклеточных условиях. Так, дисульфидные связи имеются в молекулах инсулина и иммуноглобулинов.
Инсулин - белковый гормон, синтезирующийся в β-клетках поджелудочной железы и секретируемый в кровь в ответ на повышение концентрации глюкозы в крови. В структуре инсулина имеются две дисульфидные связи, соединяющие полипептидные А- и В-цепи, и одна дисульфидная связь внутри А-цепи (рис. 1.10).
 Рис. 1.10. Дисульфидные связи в структуре инсулина
Рис. 1.10. Дисульфидные связи в структуре инсулина
5. Супервторичная структура белков. В разных по первичной структуре и функциям белках иногда выявляются сходные сочетания и взаиморасположение вторичных структур, которые называются супервторичной структурой. Она занимает промежуточное положение между вторичной и третичной структурами, поскольку это специфическое сочетание элементов вторичной структуры при формировании третичной структуры белка. Супервторичные структуры имеют специфические названия, такие как «α-спираль-поворот-а-спираль», «лейциновая застежка молния», «цинковые пальцы» и др. Такие супервторичные структуры характерны для ДНК-связывающих белков.
«Лейциновая застежка-молния». Этот вид супервторичной структуры используется для соединения двух белков. На поверхности взаимодействующих белков имеются α-спиральные участки, содержащие не менее четырех остатков лейцина. Лейциновые остатки в α-спирали располагаются через шесть аминокислот один от другого. Так как каждый виток α-спирали содержит 3,6 аминокислотных остатка, радикалы лейцина находятся на поверхности каждого второго витка. Лейциновые остатки α-спирали одного белка могут взаимодействовать с лейциновыми остатками другого белка (гидрофобные взаимодействия), соединяя их вместе (рис. 1.11.). Многие ДНК связывающие белки функционируют в составе олигомерных комплексов, где отдельные субъединицы связываются друг с другом «лейциновыми застежками».
 Рис. 1.11. «Лейциновая застежка-молния» между α-спиральными участками двух белков
Рис. 1.11. «Лейциновая застежка-молния» между α-спиральными участками двух белков
Примером таких белков могут служить гистоны. Гистоны - ядерные белки, в состав которых входит большое количество положительно заряженных аминокислот - аргинина и лизина (до 80%). Молекулы гистонов объединяются в олигомерные комплексы, содержащие восемь мономеров с помощью «лейциновых застежек», несмотря на значительный одноименный заряд этих молекул.
«Цинковый палец» - вариант супервторичной структуры, характерный для ДНК-связывающих белков, имеет вид вытянутого фрагмента на поверхности белка и содержит около 20 аминокислотных остатков (рис. 1.12). Форму «вытянутого пальца» поддерживает атом цинка, связанный с радикалами четыре аминокислот - двух остатков цистеина и двух - гистидина. В некоторых случаях вместо остатков гистидина находятся остатки цистеина. Два близко лежащих остатка цистеина отделены от двух других остатков Гисили Циспоследовательностью, состоящей примерно из 12 аминокислотных остатков. Этот участок белка образует α-спираль, радикалы которой могут специфично связываться с регуляторными участками большой бороздки ДНК. Специфичность связывания индивидуального
 Рис.
1.12. Первичная структура участка ДНК-связывающих белков, формирующих
структуру «цинкового пальца» (буквами обозначены аминокислоты, входящие в
состав этой структуры)
Рис.
1.12. Первичная структура участка ДНК-связывающих белков, формирующих
структуру «цинкового пальца» (буквами обозначены аминокислоты, входящие в
состав этой структуры)
регуляторного ДНК-связывающего белка зависит от последовательности аминокислотных остатков, расположенных в области «цинкового пальца». Такие структуры содержат, в частности, рецепторы стероидных гормонов, участвующих в регуляции транскрипции (считывание информации с ДНК на РНК).
ТЕМА 1.2. ОСНОВЫ ФУНКЦИОНИРОВАНИЯ БЕЛКОВ. ЛЕКАРСТВА КАК ЛИГАНДЫ, ВЛИЯЮЩИЕ НА ФУНКЦИЮ БЕЛКОВ
1. Активный центр белка и его взаимодействие с лигандом. В процессе формирования третичной структуры на поверхности функционально активного белка, обычно в углублении, образуется участок, сформированный радикалами аминокислот, далеко стоящими друг от друга в первичной структуре. Этот участок, имеющий уникальное строение для данного белка и способный специфично взаимодействовать с определенной молекулой или группой похожих молекул, называется центром связывания белка с лигандом или активным центром. Лигандами называются молекулы, взаимодействующие с белками.
Высокая специфичность взаимодействия белка с лигандом обеспечивается комплементарностью структуры активного центра структуре лиганда.
Комплементарность - это пространственное и химическое соответствие взаимодействующих поверхностей. Активный центр должен не только пространственно соответствовать входящему в него лиганду, но и между функциональными группами радикалов, входящих в активный центр, и лигандом должны образоваться связи (ионные, водородные, а также гидрофобные взаимодействия), которые удерживают лиганд в активном центре (рис. 1.13).
 Рис. 1.13. Комплементарное взаимодействие белка с лигандом
Рис. 1.13. Комплементарное взаимодействие белка с лигандом
Некоторые лиганды, присоединяясь к активному центру белка, выполняют вспомогательную роль в функционировании белков. Такие лиганды называются кофакторами, а белки, имеющие в своем составе небелковую часть, - сложными белками (в отличие от простых белков, состоящих только из белковой части). Небелковая часть, прочно соединенная с белком, носит название простетической группы. Например, в составе миоглобина, гемоглобина и цитохромов содержится прочно прикрепленная к активному центру простетическая группа - гем, содержащий ион железа. Сложные белки, содержащие гем, называются гемопротеинами.
При присоединении к белкам специфических лигандов проявляется функция этих белков. Так, альбумин - важнейший белок плазмы крови - проявляет свою транспортную функцию, присоединяя к активному центру гидрофобные лиганды, такие как жирные кислоты, билирубин, некоторые лекарства и др. (рис. 1.14)
Лигандами, взаимодействующими с трехмерной структурой пептидной цепи, могут быть не только низкомолекулярные органические и неорганические молекулы, но и макромолекулы:
ДНК (рассмотренные выше примеры с ДНК-связывающими белками);
Полисахариды;
 Рис. 1.14. Взаимосвязь генотипа и фенотипа
Рис. 1.14. Взаимосвязь генотипа и фенотипа
Уникальная первичная структура белков человека, закодированная в молекуле ДНК, в клетках реализуется в виде уникальной конформации, структуры активного центра и функций белков
В этих случаях белок узнает определенный участок лиганда, соразмерный и комплементарный центру связывания. Так на поверхности гепатоцитов имеются белки-рецепторы к гормону инсулину, имеющему также белковое строение. Взаимодействие инсулина с рецептором вызывает изменение его конформации и активации сигнальных систем, приводящих к запасанию в гепатоцитах питательных веществ после еды.
Таким образом, в основе функционирования белков лежит специфическое взаимодействие активного центра белка с лигандом.
2. Доменная структура и ее роль в функционировании белков. Длинные полипептидные цепи глобулярных белков часто складываются в несколько компактных, относительно независимых областей. Они имеют самостоятельную третичную структуру, напоминающую таковую у глобулярных белков, и называются доменами. Благодаря доменной структуре белков легче формируется их третичная структура.
В доменных белках центры связывания с лигандом часто располагаются между доменами. Так, трипсин - протеолитический фермент, который вырабатывается экзокринной частью поджелудочной железы и необходим для переваривания белков пищи. Он имеет двухдоменное строение, а центр связывания трипсина с его лигандом - пищевым белком - располагается в бороздке между двумя доменами. В активном центре создаются условия, необходимые для эффективного связывания специфического участка пищевого белка и гидролиза его пептидных связей.
Разные домены в белке при взаимодействии активного центра с лигандом могут перемещаться друг относительно друга (рис. 1.15).
Гексокиназа - фермент, катализирующий фосфорилирование глюкозы с помощью АТФ. Активный центр фермента располагается в расщелине между двумя доменами. При связывании гексокиназы с глюкозой окружающие ее домены смыкаются и субстрат оказывается в «ловушке», где и происходит фосфорилирование (см. рис. 1.15).
 Рис. 1.15. Связывание доменов гексокиназы с глюкозой
Рис. 1.15. Связывание доменов гексокиназы с глюкозой
В некоторых белках домены выполняют самостоятельные функции, связываясь с различными лигандами. Такие белки называются многофункциональными.
3. Лекарства - лиганды, влияющие на функцию белков. Взаимодействие белков с лигандами специфично. Однако благодаря конформационной лабильности белка и его активного центра можно подобрать другое вещество, которое также могло бы взаимодействовать с белком в активном центре или ином участке молекулы.
Вещество, по структуре похожее на природный лиганд, называют структурным аналогом лиганда или неприродным лигандом. Оно также взаимодействует с белком в активном центре. Структурный аналог лиганда может как усиливать функцию белка (агонист), так и снижать ее (антагонист). Лиганд и его структурные аналоги конкурируют друг с другом за связывание с белком в одном центре. Такие вещества называются конкурентными модуляторами (регуляторами) белковых функций. Многие лекарственные препараты действуют как ингибиторы белков. Некоторые из них получают химической модификацией природных лигандов. Ингибиторы белковых функций могут быть лекарствами и ядами.
Атропин - конкурентный ингибитор М-холинорецепторов. Ацетилхолин - нейромедиатор передачи нервного импульса через холинэргические синапсы. Для проведения возбуждения выделившийся в синаптическую щель ацетилхолин должен взаимодействовать с белком - рецептором постсинаптической мембраны. Обнаружены два типа холинорецепторов:
М-рецептор, кроме ацетилхолина избирательно взаимодействующий с мускарином (токсином мухомора). М - холинорецепторы имеются на гладких мышцах и при взаимодействии с ацетилхолином вызывают их сокращение;
Н-рецептор, специфично связывающийся с никотином. Н-холинорецепторы обнаружены в синапсах поперечнополосатых скелетных мышц.
Специфическим ингибитором М-холинорецепторов является атропин. Он содержится в растениях красавке и белене.
 Атропин
имеет в структуре схожие с ацетилхолином функциональные группы и их
пространственное расположение, поэтому относится к конкурентным
ингибиторам М-холинорецепторов. Учитывая, что связывание ацетилхолина с
М-холинорецепторами вызывает сокращение гладких мышц, атропин используют
как лекарство, снимающее их спазм (спазмолитик).
Так, известно
применение атропина для расслабления глазных мышц при просмотре глазного
дна, а также для снятия спазмов при желудочнокишечных коликах.
М-холинорецепторы имеются и в центральной нервной системе (ЦНС), поэтому
большие дозы атропина могут вызвать нежелательную реакцию со стороны
ЦНС: двигательное и психическое возбуждение, галлюцинации, судороги.
Атропин
имеет в структуре схожие с ацетилхолином функциональные группы и их
пространственное расположение, поэтому относится к конкурентным
ингибиторам М-холинорецепторов. Учитывая, что связывание ацетилхолина с
М-холинорецепторами вызывает сокращение гладких мышц, атропин используют
как лекарство, снимающее их спазм (спазмолитик).
Так, известно
применение атропина для расслабления глазных мышц при просмотре глазного
дна, а также для снятия спазмов при желудочнокишечных коликах.
М-холинорецепторы имеются и в центральной нервной системе (ЦНС), поэтому
большие дозы атропина могут вызвать нежелательную реакцию со стороны
ЦНС: двигательное и психическое возбуждение, галлюцинации, судороги.
Дитилин - конкурентный агонист Н-холинорецепторов, ингибирующий функцию нервно-мышечных синапсов.
 Нервно-мышечные
синапсы скелетных мышц содержат Н-холинорецепторы. Их взаимодействие с
ацетилхолином приводит к мышечным сокращениям. При некоторых
хирургических операциях, а также в эндоскопических исследованиях
используют препараты, вызывающие расслабление скелетных мышц (миорелаксанты).
К
ним относится дитилин, являющийся структурным аналогом ацетилхолина. Он
присоединяется к Н-холинорецепторам, но в отличие от ацетилхолина очень
медленно разрушается ферментом - ацетилхолинэстеразой. В результате
длительного открытия ионных каналов и стойкой деполяризации мембраны
нарушается проведение нервного импульса и происходит мышечное
расслабление. Первоначально эти свойства были обнаружены у яда кураре,
поэтому такие препараты называют курареподобными.
Нервно-мышечные
синапсы скелетных мышц содержат Н-холинорецепторы. Их взаимодействие с
ацетилхолином приводит к мышечным сокращениям. При некоторых
хирургических операциях, а также в эндоскопических исследованиях
используют препараты, вызывающие расслабление скелетных мышц (миорелаксанты).
К
ним относится дитилин, являющийся структурным аналогом ацетилхолина. Он
присоединяется к Н-холинорецепторам, но в отличие от ацетилхолина очень
медленно разрушается ферментом - ацетилхолинэстеразой. В результате
длительного открытия ионных каналов и стойкой деполяризации мембраны
нарушается проведение нервного импульса и происходит мышечное
расслабление. Первоначально эти свойства были обнаружены у яда кураре,
поэтому такие препараты называют курареподобными.
ТЕМА 1.3. ДЕНАТУРАЦИЯ БЕЛКОВ И ВОЗМОЖНОСТЬ ИХ СПОНТАННОЙ РЕНАТИВАЦИИ
1. Так как нативная конформация белков поддерживается за счет слабых взаимодействий, изменение состава и свойств окружающей белок среды, воздействие химических реагентов и физических факторов вызывают изменение их конформации (свойство конформационной лабильности). Разрыв большого количества связей приводит к разрушению нативной конформации и денатурации белков.
Денатурация белков - это разрушение их нативной конформации под действием денатурирующих агентов, вызванное разрывом слабых связей, стабилизирующих пространственную структуру белка. Денатурация сопровождается разрушением уникальной трехмерной структуры и активного центра белка и потерей его биологической активности (рис. 1.16).
Все денатурированные молекулы одного белка приобретают случайную конформацию, отличающуюся от других молекул того же белка. Радикалы аминокислот, формирующие активный центр, оказываются пространственно удаленными друг от друга, т.е. разрушается специфический центр связывания белка с лигандом. При денатурации первичная структура белков остается неизменной.
Применение денатурирующих агентов в биологических исследованиях и медицине. В биохимических исследованиях перед определением в биологическом материале низкомолекулярных соединений обычно из раствора вначале удаляют белки. Для этой цели чаще всего используют трихлоруксусную кислоту (ТХУ). После добавления ТХУ в раствор денатурированные белки выпадают в осадок и легко удаляются фильтрованием (табл. 1.1.)
В медицине денатурирующие агенты часто применяют для стерилизации медицинского инструмента и материала в автоклавах (денатурирующий агент - высокая температура) и в качестве антисептиков (спирт, фенол, хлорамин) для обработки загрязненных поверхностей, содержащих патогенную микрофлору.
2. Спонтанная ренативация белков - доказательство детерминированности первичной структуры, конформации и функции белков. Индивидуальные белки - это продукты одного гена, которые имеют идентичную аминокислотную последовательность и в клетке приобретают одинаковую конформацию. Фундаментальный вывод о том, что в первичной структуре белка уже заложена информация о его конформации и функции, был сделан на основе способности некоторых белков (в частности, рибонуклеазы и миоглобина) к спонтанной ренативации - восстановлению их нативной конформации после денатурации.
Формирование пространственных структур белка осуществляется способом самосборки - самопроизвольного процесса, при котором полипептидная цепь, имеющая уникальную первичную структуру, стремится принять в растворе конформацию с наименьшей свободной энергией. Способность к ренативации белков, сохраняющих после денатурации первичную структуру, описана в опыте с ферментом рибонуклеазой.
Рибонуклеаза - фермент, разрушающий связи между отдельными нуклеотидами в молекуле РНК. Этот глобулярный белок имеет одну полипептидную цепь, третичная структура которой стабилизирована множеством слабых и четырьмя дисульфидными связями.
Обработка рибонуклеазы мочевиной, разрушающей водородные связи в молекуле, и восстановителем, разрывающим дисульфидные связи, приводит к денатурации фермента и потере его активности.
Удаление денатурирующих агентов диализом приводит к восстановлению конформации и функции белка, т.е. к ренативации. (рис. 1.17).
 Рис. 1.17. Денатурация и ренативация рибонуклеазы
Рис. 1.17. Денатурация и ренативация рибонуклеазы
А - нативная конформация рибонуклеазы, в третичной структуре которой имеются четыре дисульфидные связи; Б - денатурированная молекула рибонуклеазы;
В - ренативированная молекула рибонуклеазы с восстановленной структурой и функцией
1. Заполните таблицу 1.2.
Таблица 1.2. Классификация аминокислот по полярности радикалов
2. Напишите формулу тетрапептида:
Асп - Про - Фен - Лиз
а) выделите в пептиде повторяющиеся группы, образующие пептидный остов, и вариабельные группы, представленные радикалами аминокислот;
б) обозначьте N- и С-концы;
в) подчеркните пептидные связи;
г) напишите другой пептид, состоящий из тех же аминокислот;
д) подсчитайте количество возможных вариантов тетрапептида с аналогичным аминокислотным составом.
3. Объясните роль первичной структуры белков на примере сравнительного анализа двух сходных по структуре и эволюционно близких пептидных гормонов нейрогипофиза млекопитающих - окситоцина и вазопрессина (табл. 1.3).
Таблица 1.3. Структура и функции окситоцина и вазопрессина
 Для этого:
Для этого:
а) сравните состав и последовательность аминокислот двух пептидов;
б) найдите сходство первичной структуры двух пептидов и сходство их биологического действия;
в) найдите различия в структуре двух пептидов и различие их функций;
г) сделайте вывод о влиянии первичной структуры пептидов на их функции.
4. Опишите основные этапы формирования конформации глобулярных белков (вторичная, третичная структуры, понятие о супервторичной структуре). Укажите типы связей, участвующих в формировании структур белка. Радикалы каких аминокислот могут участвовать в образовании гидрофобных взаимодействий, ионных, водородных связях.
Приведите примеры.
5. Дайте определение понятию «конформационная лабильность белков», укажите причины ее существования и значение.
6. Раскройте смысл следующей фразы: «В основе функционирования белков лежит их специфическое взаимодействие с лигандом», используя термины и объясняя их значение: конформация белка, активный центр, лиганд, комплементарность, функция белка.
7. На одном из примеров объясните, что такое домены и какова их роль в функционировании белков.
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Установите соответствие.
Функциональная группа в радикале аминокислоты:
А. Карбоксильная группа Б. Гидроксильная группа В Гуанидиновая группа Г. Тиольная группа Д. Аминогруппа
2. Выберите правильные ответы.
Аминокислоты с полярными незаряженными радикалами - это:
A. Цис Б. Асн
B. Глу Г. Три
3. Выберите правильные ответы.
Радикалы аминокислот:
A. Обеспечивают специфичность первичной структуры Б. Участвуют в формировании третичной структуры
B. Располагаясь на поверхности белка, влияют на его растворимость Г. Формируют активный центр
Д. Участвуют в образовании пептидных связей
4. Выберите правильные ответы.
Гидрофобные взаимодействия могут образовываться между радикалами аминокислот:
A. Тре Лей Б. Про Три
B. Мет Иле Г. Тир Ала Д. Вал Фен
5. Выберите правильные ответы.
Ионные связи могут образовываться между радикалами аминокислот:
A. Глн Асп Б. Apr Лиз
B. Лиз Глу Г. Гис Асп Д. Асн Apr
6. Выберите правильные ответы.
Водородные связи могут образовываться между радикалами аминокислот:
A. Сер Глн Б. Цис Тре
B. Асп Лиз Г. Глу Асп Д. Асн Тре
7. Установите соответствие.
Тип связи, участвующий в формировании структуры белка:
A. Первичная структура Б. Вторичная структура
B. Третичная структура
Г. Супервторичная структура Д. Конформация.
1. Водородные связи между атомами пептидного остова
2. Слабые связи между функциональными группами радикалов аминокислот
3. Связи между α-амино и α-карбоксильными группами аминокислот
8. Выберите правильные ответы. Трипсин:
A. Протеолитический фермент Б. Содержит два домена
B. Гидролизирует крахмал
Г. Активный центр расположен между доменами. Д. Состоит из двух полипептидных цепей.
9. Выберите правильные ответы. Атропин:
A. Нейромедиатор
Б. Структурный аналог ацетилхолина
B. Взаимодействует с Н-холинорецепторами
Г. Усиливает проведение нервного импульса через холинэргические синапсы
Д. Конкурентный ингибитор М-холинорецепторов
10. Выберите правильные утверждения. В белках:
A. Первичная структура содержит информацию о строении его активного центра
Б. Активный центр формируется на уровне первичной структуры
B. Конформация жестко фиксирована ковалентными связями
Г. Активный центр может взаимодействовать с группой похожих лигандов
благодаря конформационной лабильности белков Д. Изменение окружающей среды, может влиять на сродство активного
центра к лиганду
1. 1-В, 2-Г, 3-Б.
3. А, Б, В, Г.
7. 1-Б, 2-Д, 3-А.
8. А, Б, В, Г.
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Белок, полипептид, аминокислоты
2. Первичная, вторичная, третичная структуры белка
3. Конформация, нативная конформация белка
4. Ковалентные и слабые связи в белке
5. Конформационная лабильность
6. Активный центр белка
7. Лиганды
8. Фолдинг белков
9. Структурные аналоги лигандов
10. Доменные белки
11. Простые и сложные белки
12. Денатурация белка, денатурирующие агенты
13. Ренативация белков
Решите задачи
«Структурная организация белков и основы их функционирования»
1. Основная функция белка - гемоглобина А (НвА) - транспорт кислорода к тканям. В популяции людей известны множественные формы этого белка с измененными свойствами и функцией - так называемые аномальные гемоглобины. Например, установлено, что гемоглобин S, обнаруженный в эритроцитах больных серповидно-клеточной анемией (HbS), имеет низкую растворимость в условиях низкого парциального давления кислорода (как это имеет место в венозной крови). Это приводит к образованию агрегатов данного белка. Белок утрачивает свою функцию, выпадает в осадок, а эритроциты приобретают неправильную форму (некоторые из них образуют форму серпа) и быстрее обычного разрушаются в селезенке. В результате развивается серповидноклеточная анемия.
Единственное различие в первичной структуре НвА и обнаружено в N-концевом участке β-цепи гемоглобина. Сравните N-концевые участки β-цепи и покажите, как изменения в первичной структуре белка влияют на его свойства и функции.
 Для этого:
Для этого:
а) напишите формулы аминокислот, по которым различаются НвА и сравните свойства этих аминокислот (полярность, заряд).
б) сделайте вывод о причине снижения растворимости и нарушении транспорта кислорода в ткани.
2. На рисунке представлена схема строения белка, имеющего центр связывания с лигандом (активный центр). Объясните, почему белок обладает избирательностью в выборе лиганда. Для этого:
а) вспомните, что такое активный центр белка, и рассмотрите строение активного центра белка, представленного на рисунке;
б) напишите формулы радикалов аминокислот, входящих в состав активного центра;
в) нарисуйте лиганд, который мог бы специфически взаимодействовать с активным центром белка. Укажите на нем функциональные группы, способные образовать связи с радикалами аминокислот, входящих в состав активного центра;
г) укажите типы связей, возникающих между лигандом и радикалами аминокислот активного центра;
д) объясните, на чем основана специфичность взаимодействия белка с лигандом.
 3.
На рисунке представлен активный центр белка и несколько лигандов.
3.
На рисунке представлен активный центр белка и несколько лигандов.
Определите, какой из лигандов с наибольшей вероятностью будет взаимодействовать с активным центром белка и почему.
 Какие типы связей возникают в процессе образования комплекса белок-лиганд»?
Какие типы связей возникают в процессе образования комплекса белок-лиганд»?
4. Структурные аналоги естественных лигандов белков могут использоваться в качестве лекарственных препаратов для изменения активности белков.
Ацетилхолин - медиатор передачи возбуждения в нервно-мышечных синапсах. При взаимодействии ацетилхолина с белками - рецепторами постсинаптической мембраны скелетных мышц происходит открытие ионных каналов и мышечное сокращение. Дитилин - лекарство, применяемое при некоторых операциях для расслабления мышц, так как он нарушает передачу нервного импульса через нервно-мышечные синапсы. Объясните механизм действия дитилина как миорелаксирующего препарата. Для этого:
а) напишите формулы ацетилхолина и дитилина и сравните их структуры;
б) опишите механизм расслабляющего действия дитилина.
5. При некоторых заболеваниях у больного повышается температура тела, что рассматривают как защитную реакцию организма. Однако высокие температуры губительны для белков организма. Объясните, почему при температуре выше 40 °С нарушается функция белков и возникает угроза для жизни человека. Для этого вспомните:
1) Строение белков и связи, удерживающие его структуру в нативной конформации;
2) Как меняется структура и функция белков при повышении температуры?;
3) Что такое гомеостаз и почему он важен для поддержания здоровья человека.
Модульная единица 2 ОЛИГОМЕРНЫЕ БЕЛКИ КАК МИШЕНИ РЕГУЛЯТОРНЫХ ВОЗДЕЙСТВИЙ. СТРУКТУРНО-ФУНКЦИОНАЛЬНОЕ МНОГООБРАЗИЕ БЕЛКОВ. МЕТОДЫ РАЗДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ
Цели изучения Уметь:
1. Использовать знания об особенностях структуры и функций олигомерных белков для понимания адаптивных механизмов регуляции их функций.
2. Объяснять роль шаперонов в синтезе и поддержании конформации белков в условиях клетки.
3. Объяснять многообразие проявления жизни многообразием структур и функций синтезирующихся в организме белков.
4. Анализировать связь структуры белков с их функцией на примерах сравнения родственных гемопротеинов - миоглобина и гемоглобина, а также представителей пяти классов белков семейства иммуноглобулинов.
5. Применять знания об особенностях физико-химических свойств белков для выбора методов их очистки от других белков и примесей.
6. Интерпретировать результаты количественного и качественного состава белков плазмы крови для подтверждения или уточнения клинического диагноза.
Знать:
1. Особенности строения олигомерных белков и адаптивные механизмы регуляции их функций на примере гемоглобина.
2. Строение и функции шаперонов и их значение для поддержания нативной конформации белков в условиях клетки.
3. Принципы объединения белков в семейства по схожести их конформации и функций на примере иммуноглобулинов.
4. Методы разделения белков, основанные на особенностях их физикохимических свойств.
5. Электрофорез плазмы крови как метод оценки качественного и количественного состава белков.
ТЕМА 1.4. ОСОБЕННОСТИ СТРОЕНИЯ И ФУНКЦИОНИРОВАНИЯ ОЛИГОМЕРНЫХ БЕЛКОВ НА ПРИМЕРЕ ГЕМОГЛОБИНА
1. Многие белки имеют в своем составе несколько полипептидных цепей. Такие белки называют олигомерными, а отдельные цепи - протомерами. Протомеры в олигомерных белках соединены множеством слабых нековалентных связей (гидрофобных, ионных, водородных). Взаимодействие
протомеров осуществляется благодаря комплементарности их контактирующих поверхностей.
Количество протомеров в олигомерных белках может сильно варьировать: гемоглобин содержит 4 протомера, фермент аспартатаминотрансфераза - 12 протомеров, а в белок вируса табачной мозаики входит 2120 протомеров, соединенных нековалентными связями. Следовательно, олигомерные белки могут иметь очень большую молекулярную массу.
Взаимодействие одного протомера с другими можно рассматривать как частный случай взаимодействия белка с лигандом, так как каждый протомер служит лигандом для других протомеров. Количество и способ соединения протомеров в белке называется четвертичной структурой белка.
В состав белков могут входить одинаковые или разные по строению протомеры, например, гомодимеры - белки, содержащие два одинаковых протомера, а гетеродимеры - белки, содержащие два разных протомера.
Если в состав белков входят разные протомеры, то на них могут формироваться отличающиеся по структуре центры связывания с разными лигандами. При связывании лиганда с активным центром проявляется функция данного белка. Центр, расположенный на другом протомере, называется аллостерическим (другим, отличным от активного). Связываясь с аллостерическим лигандом или эффектором, он выполняет регуляторную функцию (рис. 1.18). Взаимодействие аллостерического центра с эффектором вызывает конформационные изменения в структуре всего олигомерного белка благодаря его конформационной лабильности. Это влияет на сродство активного центра к специфическому лиганду и регулирует функцию данного белка. Изменение конформации и функции всех протомеров при взаимодействии олигомерного белка хотя бы с одним лигандом носит название кооперативных изменений конформации. Эффекторы, усиливающие функцию белка, называются активаторами, а эффекторы, угнетающие его функцию, - ингибиторами.
Таким образом, у олигомерных белков, а также белков, имеющих доменное строение, появляется новое по сравнению с мономерными белками свойство - способность к аллостерической регуляции функций (регуляции присоединением к белку разных лигандов). Это можно проследить, сравнивая структуры и функции двух близко родственных сложных белков миоглобина и гемоглобина.
 Рис. 1.18. Схема строения димерного белка
Рис. 1.18. Схема строения димерного белка
2. Формирование пространственных структур и функционирование миоглобина.
Миоглобин (Мв) - белок, находящийся в красных мышцах, основная функция которого - создание запасов О 2 , необходимых при интенсивной мышечной работе. Мв - сложный белок, содержащий белковую часть - апоМв и небелковую часть - гем. Первичная структура апоМв определяет его компактную глобулярную конформацию и структуру активного центра, к которому присоединяется небелковая часть миоглобина - гем. Кислород, поступающий из крови в мышцы, связывается с Fe+ 2 гема в составе миоглобина. Мв - мономерный белок, имеющий очень высокое сродство к О 2 , поэтому отдача кислорода миоглобином происходит только при интенсивной мышечной работе, когда парциальное давление O 2 резко снижается.
Формирование конформации Мв. В красных мышцах на рибосомах в ходе трансляции идет синтез первичной структуры Мв, представленной специфической последовательностью 153 аминокислотных остатков. Вторичная структура Мв содержит восемь α-спиралей, называемых латинскими буквами от А до Н, между которыми имеются неспирализованные участки. Третичная структура Мв имеет вид компактной глобулы, в углублении которой между F и Е α-спиралями расположен активный центр (рис. 1.19).
 Рис. 1.19. Структура миоглобина
Рис. 1.19. Структура миоглобина
3. Особенности строения и функционирования активного центра Мв. Активный центр Мв сформирован преимущественно гидрофобными радикалами аминокислот, далеко отстоящими друг от друга в первичной структуре (например, Три 3 9 и Фен 138) К активному центру присоединяется плохо растворимые в воде лиганды - гем и О 2 . Гем - специфический лиганд апоМв (рис. 1.20), основу которого составляют четыре пиррольных кольца, соединенных метенильными мостиками; в центре расположен атом Fe+ 2 , соединенный с атомами азота пиррольных колец четырьмя координационными связями. В активном центре Мв кроме гидрофобных радикалов аминокислот имеются также остатки двух аминокислот с гидрофильными радикалами - Гис Е 7 (Гис 64) и Гис F 8 (Гис 93) (рис. 1.21).
 Рис. 1.20. Строение гема - небелковой части миоглобина и гемоглобина
Рис. 1.20. Строение гема - небелковой части миоглобина и гемоглобина
 Рис. 1.21. Расположение гема и O 2 в активном центре апомиоглобина и протомеров гемоглобина
Рис. 1.21. Расположение гема и O 2 в активном центре апомиоглобина и протомеров гемоглобина
Гем через атом железа ковалентно связан с Гис F 8 . O 2 присоединяется к железу с другой стороны плоскости гема. Гис Е 7 необходим для правильной ориентации О 2 и облегчает присоединение кислорода к Fe+ 2 гема
Гис F 8 образует координационную связь с Fe+ 2 и прочно фиксирует гем в активном центре. Гис Е 7 необходим для правильной ориентации в активном центре другого лиганда - O 2 при его взаимодействии с Fe+ 2 гема. Микроокружение гема создает условия для прочного, но обратимого связывания O 2 с Fe +2 и препятствует попаданию в гидрофобный активный центр воды, что может привести к его окислению в Fе+ 3 .
Мономерное строение Мв и его активного центра определяет высокое сродство белка к О 2 .
4. Олигомерное строение Нв и регуляция сродства Нв к О 2 лигандами. Гемоглобины человека - семейство белков, так же как и миоглобин относящиеся к сложным белкам (гемопротеинам). Они имеют тетрамерное строение и содержат две α-цепи, но различаются по строению двух других полипептидных цепей (2α-, 2х-цепи). Строение второй полипептидной цепи определяет особенности функционирования этих форм Нв. Около 98% гемоглобина эритроцитов взрослого человека составляет гемоглобин А (2α-, 2р-цепи).
В период внутриутробного развития функционируют два основных типа гемоглобинов: эмбриональный Нв (2α, 2ε), который обнаруживается на ранних этапах развития плода, и гемоглобин F (фетальный) - (2α, 2γ), который приходит на смену раннему гемоглобину плода на шестом месяце внутриутробного развития и только после рождения замещается на Нв А.
Нв А - белок, родственный миоглобину (Мв), содержится в эритроцитах взрослого человека. Строение его отдельных протомеров аналогично таковому у миоглобина. Вторичная и третичная структуры миоглобина и протомеров гемоглобина очень сходны, несмотря на то что в первичной структуре их полипептидных цепей идентичны только 24 аминокислотных остатка (вторичная структура протомеров гемоглобина, так же как миоглобин, содержит восемь α-спиралей, обозначаемых латинскими буквами от А до Н, а третичная структура имеет вид компактной глобулы). Но в отличие от миоглобина гемоглобин имеет олигомерное строение, состоит из четырех полипептидных цепей, соединенных нековалентными связями (рис 1.22).
Каждый протомер Нв связан с небелковой частью - гемом и соседними протомерами. Соединение белковой части Нв с гемом аналогично таковому у миоглобина: в активном центре белка гидрофобные части гема окружены гидрофобными радикалами аминокислот за исключением Гис F 8 и Гис Е 7 , которые расположены по обе стороны от плоскости гема и играют аналогичную роль в функционировании белка и связывании его с кислородом (см. строение миоглобина).
 Рис. 1.22. Олигомерная структура гемоглобина
Рис. 1.22. Олигомерная структура гемоглобина
Кроме того, Гис Е 7 выполняет важную дополнительную роль в функционировании Нв. Свободный гем имеет в 25 000 раз более высокое сродство к СО, чем к О 2 . СО в небольших количествах образуется в организме и, учитывая его высокое сродство к гему, он мог бы нарушать транспорт необходимого для жизни клеток О 2 . Однако в составе гемоглобина сродство гема к оксиду углерода превышает сродство к О 2 всего в 200 раз благодаря наличию в активном центре Гис Е 7 . Остаток этой аминокислоты создает оптимальные условия для связывания гема с O 2 и ослабляет взаимодействие гема с СО.
5. Основная функция Нв - транспорт О 2 из легких в ткани. В отличие от мономерного миоглобина, имеющего очень высокое сродство к О 2 и выполняющего функцию запасания кислорода в красных мышцах, олигомерная структура гемоглобина обеспечивает:
1) быстрое насыщение Нв кислородом в легких;
2) способность Нв отдавать кислород в тканях при относительно высоком парциальном давлении O 2 (20-40 мм рт. ст.);
3) возможность регуляции сродства Нв к О 2 .
6. Кооперативные изменения конформации протомеров гемоглобина ускоряют связывание O 2 в легких и отдачу его в ткани. В легких высокое парциальное давление O 2 способствует связыванию его с Нв в активном центре четырех протомеров (2α и 2β). Активный центр каждого протомера, так же как и в миоглобине, расположен между двумя α-спиралями (F и Е) в гидрофобном кармане. Он содержит небелковую часть - гем, прикрепленный к белковой части множеством слабых гидрофобных взаимодействий и одной прочной связью между Fe 2 + гема и Гис F 8 (см. рис. 1.21).
В дезоксигемоглобине, благодаря этой связи с Гис F 8 , атом Fe 2 + выступает из плоскости гема по направлению к гистидину. Связывание O 2 с Fe 2 + происходит по другую сторону гема в области Гис Е 7 с помощью единственной свободной координационной связи. Гис Е 7 обеспечивает оптимальные условия для связывания O 2 с железом гема.
Присоединение O 2 к атому Fe +2 одного протомера вызывает его перемещение в плоскость гема, а за ним и остатка гистидина, связанного с ним
 Рис. 1.23. Изменение конформации протомера гемоглобина при соединении с O 2
Рис. 1.23. Изменение конформации протомера гемоглобина при соединении с O 2
Это приводит к изменению конформации всех полипептидных цепей за счет их конформационной лабильности. Изменение конформации других цепей облегчает их взаимодействие со следующими молекулами О 2 .
Четвертая молекула О 2 присоединяется к гемоглобину в 300 раз легче, чем первая (рис. 1.24).
 Рис. 1.24. Кооперативные изменения конформации протомеров гемоглобина при его взаимодействии с О 2
Рис. 1.24. Кооперативные изменения конформации протомеров гемоглобина при его взаимодействии с О 2
В тканях каждая следующая молекула O 2 отщепляется легче, чем предыдущая, также за счет кооперативных изменений конформации протомеров.
7. CO 2 и Н+, образующиеся при катаболизме органических веществ, уменьшают сродство гемоглобина к О 2 пропорционально их концентрации. Энергия, необходимая для работы клеток, вырабатывается преимущественно в митохондриях при окислении органических веществ с использованием O 2 , доставляемого из легких гемоглобином. В результате окисления органических веществ образуются конечные продукты их распада: СО 2 и K 2 O, количество которых пропорционально интенсивности протекающих процессов окисления.
СO 2 диффузией попадает из клеток в кровь и проникает в эритроциты, где под действием фермента карбангидразы превращается в угольную кислоту. Эта слабая кислота диссоциирует на протон и бикарбонат ион.
Н+ способны присоединятся к радикалам Гис 14 6 в α- и β-цепях гемоглобина, т.е. в участках, удаленных от гема. Протонирование гемоглобина снижает его сродство к О 2 , способствует отщеплению О 2 от оксиНв, образованию дезоксиНв и увеличивает поступление кислорода в ткани пропорционально количеству образовавшихся протонов (рис. 1.25).
Увеличение количества освобожденного кислорода в зависимости от увеличения концентрации Н+ в эритроцитах называется эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект).
В легких высокое парциальное давление кислорода способствует его связыванию с дезоксиНв, что уменьшает сродство белка к Н + . Освободившиеся протоны под действием карбангидразы взаимодействуют с бикарбонатами с образованием СО 2 и Н 2 О

 Рис. 1.25. Зависимость сродства Нв к О 2 от концентрации СО 2 и протонов (эффект Бора):
Рис. 1.25. Зависимость сродства Нв к О 2 от концентрации СО 2 и протонов (эффект Бора):
А - влияние концентрации СО 2 и Н+ на высвобождение О 2 из комплекса с Нв (эффект Бора); Б - оксигенирование дезоксигемоглобина в легких, образование и выделение СО 2 .
Образовавшийся СО 2 поступает в альвеолярное пространство и удаляется с выдыхаемым воздухом. Таким образом, количество высвобождаемого гемоглобином кислорода в тканях регулируется продуктами катаболизма органических веществ: чем интенсивнее распад веществ, например при физических нагрузках, тем выше концентрация СО 2 и Н + и тем больше кислорода получают ткани в результате уменьшения сродства Нв к О 2 .
8. Аллостерическая регуляция сродства Нв к О 2 лигандом - 2,3-бис- фосфоглицератом. В эритроцитах из продукта окисления глюкозы - 1,3-бисфосфоглицерата синтезируется аллостерический лиганд гемоглобина - 2,3-бисфосфоглицерат (2,3-БФГ). В нормальных условиях концентрация 2,3-БФГ высокая и сравнима с концентрацией Нв. 2,3-БФГ имеет сильный отрицательный заряд -5.
 Бисфосфоглицерат
в капиллярах тканей, связываясь с дезоксигемоглобином, увеличивает
выход кислорода в ткани, уменьшая сродство Нв к О 2 .
Бисфосфоглицерат
в капиллярах тканей, связываясь с дезоксигемоглобином, увеличивает
выход кислорода в ткани, уменьшая сродство Нв к О 2 .
В центре тетрамерной молекулы гемоглобина находится полость. Ее образуют аминокислотные остатки всех четырех протомеров (см. рис. 1.22). В капиллярах тканей протонирование Нв (эффект Бора) приводит к разрыву связи между железом гема и О 2 . В молекуле
дезоксигемоглобина по сравнению с оксигемоглобином возникают дополнительные ионные связи, соединяющие протомеры, вследствие чего размеры центральной полости по сравнению с оксигемоглобином увеличиваются. Центральная полость является местом присоединения 2,3-БФГ к гемоглобину. Из-за различия в размерах центральной полости 2,3-БФГ может присоединяться только к дезоксигемоглобину.
2,3-БФГ взаимодействует с гемоглобином в участке, удаленном от активных центров белка и относится к аллостерическим (регуляторным) лигандам, а центральная полость Нв является аллостерическим центром. 2,3-БФГ имеет сильный отрицательный заряд и взаимодействует с пятью положительно заряженными группами двух β-цепей Нв: N-концевой α-аминогруппой Вал и радикалами Лиз 82 Гис 143 (рис. 1.26).
 Рис. 1.26. БФГ в центральной полости дезоксигемоглобина
Рис. 1.26. БФГ в центральной полости дезоксигемоглобина
БФГ связывается с тремя положительно заряженными группами в каждой β-цепи.
В капиллярах тканей образующийся дезоксигемоглобин взаимодействует с 2,3-БФГ и между положительно заряженными радикалами β-цепей и отрицательно заряженным лигандом образуются ионные связи, которые изменяют конформацию белка и снижают сродство Нв к О 2 . Уменьшение сродства Нв к О 2 способствует более эффективному выходу О 2 в ткани.
В легких при высоком парциальном давлении кислород взаимодействует с Нв, присоединяясь к железу гема; при этом изменяется конформация белка, уменьшается центральная полость и происходит вытеснение 2,3-БФГ из аллостерического центра
Таким образом, олигомерные белки обладают новыми по сравнению с мономерными белками свойствами. Присоединение лигандов на участках,
пространственно удаленных друг от друга (аллостерических), способно вызывать конформационные изменения во всей белковой молекуле. Благодаря взаимодействию с регуляторными лигандами происходит изменение конформации и адаптация функции белковой молекулы к изменениям окружающей среды.
ТЕМА 1.5. ПОДДЕРЖАНИЕ НАТИВНОЙ КОНФОРМАЦИИ БЕЛКОВ В УСЛОВИЯХ КЛЕТКИ
В клетках в процессе синтеза полипептидных цепей, их транспорта через мембраны в соответствующие отделы клетки, в процессе фолдинга (формирования нативной конформации) и при сборке олигомерных белков, а также в период их функционирования в структуре белков возникают промежуточные, склонные к агрегации, нестабильные конформации. Гидрофобные радикалы, в нативной конформации обычно спрятанные внутри белковой молекулы, в нестабильной конформации оказываются на поверхности и стремятся к объединению с такими же плохо растворимыми в воде группами других белков. В клетках всех известных организмов обнаружены специальные белки, которые обеспечивают оптимальный фолдинг белков клетки, стабилизируют их нативную конформацию при функционировании и, что особенно важно, поддерживают структуру и функции внутриклеточных белков при нарушении гомеостаза. Эти белки получили название «шапероны», что в переводе с французского обозначает «няня».
1. Молекулярные шапероны и их роль в предотвращении денатурации белков.
Шапероны (Ш) классифицируются по массе субъединиц. Высокомолекулярные шапероны имеют массу от 60 до 110 кД. Среди них наиболее изучены три класса: Ш-60, Ш-70 и Ш-90. Каждый класс включает семейство родственных белков. Так, в состав Ш-70 входят белки с молекулярной массой от 66 до 78 кД. Низкомолекулярные шапероны имеют молекулярную массу от 40 до 15 кД.
Среди шаперонов различают конститутивные белки, высокий базальный синтез которых не зависит от стрессовых воздействий на клетки организма, и индуцибельные, синтез которых в нормальных условиях идет слабо, но резко возрастает при стрессовых воздействиях. Индуцибельные шапероны называют также «белками теплового шока», так как впервые они были обнаружены в клетках, подвергавшихся воздействию высоких температур. В клетках из-за высокой концентрации белков самопроизвольная ренативация частично денатурированных белков затруднена. Ш-70 могут предотвращать начавшийся процесс денатурации и способствовать восстановлению нативной конформации белков. Молекулярные шапероны-70 - высококонсервативный класс белков, находящихся во всех отделах клетки: цитоплазме, ядре, эндоплазматическом ретикулуме, митохондриях. На карбоксильном конце единственной полипептидной цепи Ш-70 имеется участок, который представляет собой бороздку, способный взаимодействовать с пептидами длиной
от 7 до 9 аминокислотных остатков, обогащенных гидрофобными радикалами. Такие участки в глобулярных белках встречаются примерно через каждые 16 аминокислот. Ш-70 способны защищать белки от температурной инактивации и восстанавливать конформацию и активность частично денатурированных белков.
2. Роль шаперонов в фолдинге белков. При синтезе белков на рибосоме N-концевая область полипептида синтезируется раньше С-концевой. Для формирования нативной конформации необходима полная аминокислотная последовательность белка. В процессе синтеза белков шапероны-70, благодаря строению их активного центра, способны закрывать склонные к агрегации участки полипептида, обогащенные гидрофобными радикалами аминокислот до завершения синтеза (рис 1.27, А).
 Рис. 1.27. Участие шаперонов в фолдинге белков
Рис. 1.27. Участие шаперонов в фолдинге белков
А - участие шаперонов-70 в предотвращении гидрофобных взаимодействий между участками синтезирующегося полипептида; Б - формирование нативной конформации белка в шапероновом комплексе
Многие высокомолекулярные белки, имеющие сложную конформацию, например доменное строение, осуществляют фолдинг в специальном пространстве, сформированном Ш-60. Ш-60 функционируют в виде олигомерного комплекса, состоящего из 14 субъединиц. Они формируют два полых кольца, каждое из которых состоит из семи субъединиц, эти кольца соединены друг с другом. Каждая субъединица Ш-60 состоит из трех доменов: апикального (верхушечного), обогащенного гидрофобными радикалами, обращенными в полость кольца, промежуточного и экваториального (рис. 1.28).
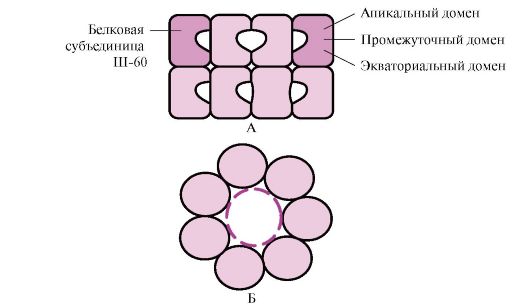 Рис. 1.28 . Структура шаперонинового комплекса, состоящего из 14 Ш-60
Рис. 1.28 . Структура шаперонинового комплекса, состоящего из 14 Ш-60
А - вид сбоку; Б - вид сверху
Синтезированные белки, имеющие на поверхности элементы, характерные для несвернутых молекул, в частности гидрофобные радикалы, попадают в полость шапероновых колец. В специфической среде этих полостей происходит перебор возможных конформаций, пока не будет найдена единственная, энергетически наиболее выгодная (рис. 1.27, Б). Формирование конформаций и высвобождение белка сопровождается гидролизом АТФ в экваториальной области. Обычно такой шаперонозависимый фолдинг требует затрат значительного количества энергии.
Кроме участия в формировании трехмерной структуры белков и ренативации частично денатурированных белков, шапероны также необходимы для протекания таких фундаментальных процессов, как сборка олигомерных белков, узнавание и транспорт в лизосомы денатурированных белков, транспорт белков через мембраны, участие в регуляции активности белковых комплексов.
ТЕМА 1.6. МНОГООБРАЗИЕ БЕЛКОВ. СЕМЕЙСТВА БЕЛКОВ НА ПРИМЕРЕ ИММУНОГЛОБУЛИНОВ
1. Белки играют решающую роль в жизнедеятельности отдельных клеток и всего многоклеточного организма, а их функции удивительно многообразны. Это определяется особенностями первичной структуры и конформаций белков, уникальностью строения активного центра и способностью связывать специфические лиганды.
Лишь очень небольшая часть всех возможных вариантов пептидных цепей может принять стабильную пространственную структуру; большинство
из них может принимать множество конформаций с примерно одинаковой энергией Гиббса, но с различными свойствами. Первичная структура большинства известных белков, отобранных биологической эволюцией, обеспечивает исключительную стабильность одной из конформаций, которая определяет особенности функционирования этого белка.
2. Семейства белков. В пределах одного биологического вида замены аминокислотных остатков могут приводить к возникновению разных белков, выполняющих родственные функции и имеющих гомологичные последовательности аминокислот. Такие родственные белки имеют поразительно сходные конформации: количество и взаиморасположение α-спиралей и (или) β-структур, большинство поворотов и изгибов полипептидных цепей похожи или идентичны. Белки с гомологичными участками полипептидной цепи, сходной конформацией и родственными функциями выделяют в семейства белков. Примеры семейств белков: сериновые протеиназы, семейство иммуноглобулинов, семейство миоглобина.
Сериновые протеиназы - семейство белков, выполняющих функцию протеолитических ферментов. К ним относятся пищеварительные ферменты - химотрипсин, трипсин, эластаза и многие факторы свертывания крови. Эти белки имеют в 40% положений идентичные аминокислоты и очень близкую конформацию (рис. 1.29).

Рис. 1.29 . Пространственные структуры эластазы (А) и химотрипсина (Б)
Некоторые аминокислотные замены привели к изменению субстратной специфичности этих белков и возникновению функционального многообразия внутри семейства.
3. Семейство иммуноглобулинов. В работе иммунной системы огромную роль играют белки суперсемейства иммуноглобулинов, которое включает в себя три семейства белков:
Антитела (иммуноглобулины);
Рецепторы Т-лимфоцитов;
Белки главного комплекса гистосовместимости - МНС 1-го и 2-го классов (Major Histocompatibility Complex).
Все эти белки имеют доменное строение, состоят из гомологичных иммуноподобных доменов и выполняют сходные функции: взаимодействуют с чужеродными структурами, либо растворенными в крови, лимфе или межклеточной жидкости (антитела), либо находящимися на поверхности клеток (собственных или чужеродных).
4. Антитела - специфические белки, вырабатываемые В-лимфоцитами в ответ на попадание в организм чужеродной структуры, называемой антигеном.
Особенности строения антител
Простейшие молекулы антител состоят из четырех полипептидных цепей: двух идентичных легких - L, содержащих около 220 аминокислот, и двух идентичных тяжелых - Н, состоящих из 440-700 аминокислот. Все четыре цепи в молекуле антитела соединены множеством нековалентных связей и четырьмя дисульфидными связями (рис. 1.30).
Легкие цепи антитела состоят из двух доменов: вариабельного (VL), находящегося в N-концевой области полипептидной цепи, и константного (CL), расположенного на С-конце. Тяжелые цепи обычно имеют четыре домена: один вариабельный (VH), находящийся на N-конце, и три константных (CH1, CH2, СНЗ) (см. рис. 1.30). Каждый домен иммуноглобулина имеет β-складчатую суперструктуру, в которой два остатка цистеина соединены дисульфидной связью.
Между двумя константными доменами СН1 и СН2 имеется участок, содержащий большое число остатков пролина, которые препятствуют формированию вторичной структуры и взаимодействию соседних Н-цепей на этом отрезке. Эта шарнирная область придает молекуле антитела гибкость. Между вариабельными доменами тяжелых и легких цепей находятся два идентичных антигенсвязывающих участка (активные центры для связывания антигенов), поэтому такие антитела часто называют бивалентами. В связывании антигена с антителом участвует не вся аминокислотная последовательность вариабельных участков обеих цепей, а всего лишь 20-30 аминокислот, расположенных в гипервариабельных областях каждой цепи. Именно эти области определяют уникальную способность каждого вида антитела взаимодействовать с соответствующим комплементарным антигеном.
Антитела - одна из линий защиты организма против внедрившихся чужеродных организмов. Их функционирование можно разделить на два этапа: первый этап - узнавание и связывание антигена на поверхности чужеродных организмов, что возможно благодаря наличию в структуре антитела антигенсвязывающих участков; второй этап - инициация процесса инактивации и разрушения антигена. Специфичность второго этапа зависит от класса антител. Существует пять классов тяжелых цепей, отличающихся друг от друга по строению константных доменов: α, δ, ε, γ и μ, в соответствии с которыми различают пять классов иммуноглобулинов: A, D, Е, G и М.
Особенности строения тяжелых цепей придают шарнирным участкам и С-концевым областям тяжелых цепей характерную для каждого класса конформацию. После связывания антигена с антителом конформационные изменения константных доменов определяют путь удаления антигена.
 Рис. 1. 30. Доменное строение IgG
Рис. 1. 30. Доменное строение IgG
Иммуноглобулины М
Иммуноглобулины М имеют две формы.
Мономерная форма - 1-й класс антител, продуцируемый развивающимся В-лимфоцитом. Впоследствии многие В-клетки переключаются на выработку других классов антител, но с тем же антигенсвязывающим участком. IgM встраивается в мембрану и выполняет роль антигенраспознающего рецептора. Встраивание IgM в мембрану клеток возможно благодаря наличию в хвостовой части участка 25 гидрофобных аминокислотных остатков.
Секреторная форма IgM содержит пять мономерных субъединиц, связанных друг с другом дисульфидными связями и дополнительной полипептидной J-цепью (рис. 1.31). Тяжелые цепи мономеров этой формы не содержат гидрофобной хвостовой части. Пентамер имеет 10 центров связывания с антигеном и поэтому эффективен в распознавании и удалении впервые попавшего в организм антигена. Секреторная форма IgM - основной класс антител, секретируемых в кровь при первичном иммунном ответе. Связывание IgM с антигеном изменяет конформацию IgM и индуцирует связывание его с первым белковым компонентом системы комплемента (система комплемента - набор белков, участвующих в уничтожении антигена) и активацию этой системы. Если антиген расположен на поверхности микроорганизма, система комплемента вызывает нарушение целостности клеточной мембраны и гибель бактериальной клетки.
Иммуноглобулины G
В количественном отношении этот класс иммуноглобулинов преобладает в крови (75% от всех Ig). IgG - мономеры, основной класс антител, секретируемый в кровь при вторичном иммунном ответе. После взаимодействия IgG с поверхностными антигенами микроорганизмов комплекс антиген-антитело способен связывать и активировать белки системы комплемента или может взаимодействовать со специфическими рецепторами макрофагов и нейтрофилов. Взаимодействие с фагоцитами приводит
 Рис. 1.31. Строение секреторной формы IgM
Рис. 1.31. Строение секреторной формы IgM
к поглощению комплексов антиген-антитело и разрушению их в фагосомах клеток. IgG - единственный класс антител, которые способны проникать через плацентарный барьер и обеспечивать внутриутробную защиту плода от инфекций.
Иммуноглобулины А
Основной класс антител, присутствующий в секретах (молоке, слюне, секретах дыхательных путей и кишечного тракта). IgA секретируются в основном в димерной форме, где мономеры связаны друг с другом через дополнительную J-цепь (рис. 1.32).
IgA не взаимодействуют с системой комплемента и фагоцитирующими клетками, но, связываясь с микроорганизмами, антитела препятствуют их присоединению к эпителиальным клеткам и проникновению в организм.
Иммуноглобулины Е
Иммуноглобулины Е представлены мономерами, в которых тяжелые ε-цепи содержат, так же как и μ-цепи иммуноглобулинов М, один вариабельный и четыре константных домена. IgE после секреции связываются своими
 Рис. 1.32. Строение IgA
Рис. 1.32. Строение IgA
С-концевыми участками с соответствующими рецепторами на поверхности тучных клеток и базофилов. В результате они становятся рецепторами для антигенов на поверхности данных клеток (рис. 1.33).
 Рис. 1.33. Взаимодействие IgE с антигеном на поверхности тучной клетки
Рис. 1.33. Взаимодействие IgE с антигеном на поверхности тучной клетки
После того как происходит присоединение антигена к соответствующим антигенсвязывающим участкам IgE, клетки получают сигнал к секреции биологически активных веществ (гистамина, серотонина), которые в большой мере ответственны за развитие воспалительной реакции и за проявление таких аллергических реакций, как астма, крапивница, сенная лихорадка.
Иммуноглобулины D
Иммуноглобулины D обнаружены в сыворотке в очень небольшом количестве, они являются мономерами. В тяжелых δ-цепях имеются один вариабельный и три константных домена. IgD выполняют роль рецепторов В-лимфоцитов, другие функции пока неизвестны. Взаимодействие специфических антигенов с рецепторами на поверхности В-лимфоцитов (IgD) приводит к передаче этих сигналов в клетку и включению механизмов, обеспечивающих размножение данного клона лимфоцитов.
ТЕМА 1.7. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ И МЕТОДЫ ИХ РАЗДЕЛЕНИЯ
1. Индивидуальные белки различаются по физико-химическим свойствам:
Форме молекул;
Молекулярной массе;
Суммарному заряду, величина которого зависит от соотношения анионных и катионных групп аминокислот;
Соотношению полярных и неполярных радикалов аминокислот на поверхности молекул;
Степени устойчивости к воздействию различных денатурирующих агентов.
2. Растворимость белков зависит от свойств белков, перечисленных выше, а также от состава среды, в которой растворяется белок (значения рН, солевого состава, температуры, наличия других органических веществ, способных взаимодействовать с белком). Величина заряда белковых молекул - один из факторов, влияющих на их растворимость. При потере заряда в изоэлектрической точке белки легче агрегируют и выпадают в осадок. Это особенно характерно для денатурированных белков, у которых на поверхности оказываются гидрофобные радикалы аминокислот.
На поверхности белковой молекулы имеются как положительно, так и отрицательно заряженные радикалы аминокислот. Количество этих групп, а следовательно, и суммарный заряд белков зависят от рН среды, т.е. соотношения концентрации Н+- и ОН - -групп. В кислой среде повышение концентрации Н+ приводит к подавлению диссоциации карбоксильных групп -СОО - + Н+ > - СООН и понижению отрицательного заряда белков. В щелочной среде связывание избытка ОН - протонами, образующимися при диссоциации аминогрупп -NH 3 + + ОН - - NH 2 + Н 2 О с образованием воды, приводит к уменьшению положительного заряда белков. Значение рН, при котором белок имеет суммарный нулевой заряд, называется изоэлектрической точкой (ИЭТ). В ИЭТ число положительно и отрицательно заряженных групп одинаково, т.е. белок находится в изоэлектрическом состоянии.
3. Разделение индивидуальных белков. Особенности строения и функционирования организма зависят от набора белков, синтезирующихся в нем. Изучение строения и свойств белков невозможно без их выделения из клетки и очистки от других белков и органических молекул. Стадии выделения и очистки индивидуальных белков:
Разрушение клеток изучаемой ткани и получение гомогената.
Разделение гомогената на фракции центрифугированием, получение ядерной, митохондриальной, цитозольной или иной фракции, содержащей искомый белок.
Избирательная тепловая денатурация - кратковременное нагревание раствора белков, при котором можно удалить часть денатурированных белковых примесей (в том случае, если белок относительно термостабилен).
Высаливание. Различные белки выпадают в осадок при разных концентрациях соли в растворе. Постепенно повышая концентрацию соли, можно получить ряд отдельных фракций с преимущественным содержанием выделяемого белка в одной из них. Наиболее часто для фракционирования белков используют сульфат аммония. Белки с наименьшей растворимостью выпадают в осадок при небольших концентрациях солей.
Гель-фильтрация - метод просеивания молекул через набухшие гранулы сефадекса (трехмерные полисахаридные цепи декстрана, имеющие поры). Скорость прохождения белков через колонку, заполненную сефадексом, будет зависеть от их молекулярной массы: чем меньше масса молекул белка, тем легче они проникают внутрь гранул и дольше там задерживаются, чем больше масса, тем быстрее они элюируют с колонки.
Ультрацентрифугирование - метод, заключающийся в том, что белки в центрифужной пробирке помещают в ротор ультрацентрифуги. При вращении ротора скорость оседания белков пропорциональна их молекулярной массе: фракции более тяжелых белков расположены ближе ко дну пробирки, более легкие - ближе к поверхности.
Электрофорез - метод, в основе которого лежат различия в скорости движения белков в электрическом поле. Эта величина пропорциональна заряду белков. Электрофорез белков проводят на бумаге (в этом случае скорость движения белков пропорциональна только их заряду) или в полиакриламидном геле с определенной величиной пор (скорость движения белков пропорциональна их заряду и молекулярной массе).
Ионообменная хроматография - метод фракционирования, основанный на связывании ионизированных групп белков с противоположно заряженными группами ионообменных смол (нерастворимых полимерных материалов). Прочность связывания белка со смолой пропорциональна заряду белка. Белки, адсорбированные на ионообменном полимере, можно смыть растворами NaCl с возрастающими концентрациями; чем меньше заряд белка, тем меньшая концентрация NaCl потребуется, чтобы смыть белок, связанный с ионогенными группами смолы.
Аффинная хроматография - наиболее специфический метод выделения индивидуальных белков.К инертному полимеру ковалентно присоединяется лиганд какого-либо белка. При пропускании раствора белков через колонку с полимером за счет комплементарного связывания белка с лигандом на колонке адсорбируется только специфичный для данного лиганда белок.
Диализ - метод, применяемый для удаления низкомолекулярных соединений из раствора выделяемого белка. Метод основан на неспособности белков проходить через полупроницаемую мембрану в отличие от низкомолекулярных веществ. Применяется для очистки белков от низкомолекулярных примесей, например от солей после высаливания.
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Заполните табл. 1.4.
Таблица 1.4. Сравнительный анализ структуры и функций родственных белков - миоглобина и гемоглобина
а) вспомните строение активного центра Мв и НЬ. Какую роль играют гидрофобные радикалы аминокислот в формировании активных центров этих белков? Опишите строение активного центра Мв и НЬ и механизмы присоединения к нему лигандов. Какую роль играют остатки Гис F 8 и Гис Е 7 в функционировании активного центра Мв иНв?
б) какими новыми свойствами по сравнению с мономерным миоглобином обладает близко родственный олигомерный белок - гемоглобин? Объясните роль кооперативных изменений конформации протомеров в молекуле гемоглобина, влияние концентраций СО 2 и протонов на сродство гемоглобина к кислороду, а также роль 2,3-БФГ в аллостерической регуляции функции НЬ.
2. Дайте характеристику молекулярным шаперонам, обращая внимание на связь их структуры с функцией.
3. Какие белки объединяют в семейства? На примере семейства иммуноглобулинов определите сходные черты строения и родственные функции белков этого семейства.
4. Часто для биохимических и медицинских целей требуются очищенные индивидуальные белки. Объясните, на каких физико-химических свойствах белков основаны используемые методы их разделения и очистки.
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выберите правильные ответы.
Функции гемоглобина:
A. Транспорт О 2 из легких в ткани Б. Транспорт Н + из тканей в легкие
B. Поддержание постоянства рН крови Г. Транспорт СО 2 из легких в ткани
Д. Транспорт СО 2 из тканей в легкие
2. Выберите правильные ответы. Лигандом α-протомера Нв является: A. Гем
Б. Кислород
B. СО Г. 2,3-БФГ
Д. β-Протомер
3. Выберите правильные ответы.
Гемоглобин в отличие от миоглобина:
A. Имеет четвертичную структуру
Б. Вторичная структура представлена только α-спиралями
B. Относится к сложным белкам
Г. Взаимодействует с аллостерическим лигандом Д. Ковалентно связан с гемом
4. Выберите правильные ответы.
Сродство Нв к О 2 уменьшается:
A. При присоединении одной молекулы О 2 Б. При отщеплении одной молекулы О 2
B. При взаимодействии с 2,3-БФГ
Г. При присоединении к протомерам Н + Д. При снижении концентрации 2,3-БФГ
5. Установите соответствие.
Для типов Нв характерно:
A. В дезокси форме образует фибриллярные агрегаты Б. Содержит в составе две α- и две δ-цепи
B. Преобладающая форма Нв в эритроцитах взрослого человека Г. В активном центре содержит гем с Fе+ 3
Д. Содержит в составе две α- и две γ-цепи 1. НвА 2.
6. Установите соответствие.
Лиганды Нв:
A. Связывается с Нв в аллостерическом центре
Б. Имеет очень высокое сродство к активному центру Нв
B. Присоединяясь, повышает сродство Нв к O 2 Г. Окисляет Fe+ 2 в Fе+ 3
Д. Образует ковалентную связь с гисF8
7. Выберите правильные ответы.
Шапероны:
A. Белки, присутствующие во всех отделах клетки
Б. Синтез усиливается при стрессовых воздействиях
B. Участвуют в гидролизе денатурированных белков
Г. Участвуют в поддержании нативной конформации белков
Д. Создают органеллы, в которых формируется конформация белков
8. Установите соответствие. Иммуноглобулины:
A. Секреторная форма имеет пентамерную форму
Б. Класс Ig, проникающих через плацентарный барьер
B. Ig - рецептор тучных клеток
Г. Основной класс Ig, присутствующих в секретах эпителиальных клеток. Д. Рецептор В-лимфоцитов, активация которого обеспечивает размножение клеток
9. Выберите правильные ответы.
Иммуноглобулины Е:
A. Вырабатываются макрофагами Б. Имеют тяжелые ε-цепи.
B. Встраиваются в мембрану Т-лимфоцитов
Г. Выполняют роль мембранных рецепторов антигенов на тучных клетках и базофилах
Д. Ответственны за проявление аллергических реакций
10. Выберите правильные ответы.
Метод разделения белков основан на различиях в их молекулярной массе:
A. Гель-фильтрация
Б. Ультрацентрифугирование
B. Электрофорез в полиакриламидном геле Г. Ионообменная хроматография
Д. Аффинная хроматография
11. Выберите правильный ответ.
Метод разделения белков основан на различиях в их растворимости в воде:
A. Гель-фильтрация Б. Высаливание
B. Ионообменная хроматография Г. Аффинная хроматография
Д. Электрофорез в полиакриламидном геле
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. А, Б, В, Д
2. А, Б, В, Д
5. 1-В, 2-А, 3-Г
6. 1-В, 2-Б, 3-А
7. А, Б, Г, Д
8. 1-Г; 2-Б, 3-В
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Олигомерные белки, протомер, четвертичная структура белков
2. Кооперативные изменения конформации протомеров
3. Эффект Бора
4. Аллостерическая регуляция функций белков, аллостерический центр и аллостерический эффектор
5. Молекулярные шапероны, белки теплового шока
6. Семейства белков (сериновые протеазы, иммуноглобулины)
7. IgM-, G-, Е-, А-связь структуры с функцией
8. Суммарный заряд белков, изоэлектрическая точка белков
9. Электрофорез
10. Высаливание
11. Гель-фильтрация
12. Ионообменная хроматография
13. Ультрацентрифугирование
14. Аффинная хроматография
15. Электрофорез белков плазмы крови
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
1. Сравните зависимости степеней насыщения гемоглобина (Нв) и миоглобина (Mb) кислородом от его парциального давления в тканях
 Рис. 1.34. Зависимость насыщения Мв и
НЬ
кислородом от его парциального давления
Рис. 1.34. Зависимость насыщения Мв и
НЬ
кислородом от его парциального давления
Обратите внимание, что форма кривых насыщения белков кислородом различна: для миоглобина - гипербола, для гемоглобина - сигмоидная форма.
1. сравните значения парциального давления кислорода, при котором Мв и Нв насыщены О 2 на 50%. Какой из этих белков характеризуется более высоким сродством к О 2 ?
2. какие особенности строения Мв определяют его высокое сродство к О 2 ?
3. какие особенности строения Нв позволяют ему отдавать О 2 в капиллярах покоящихся тканей (при относительно высоком парциальном давлении О 2) и резко увеличивать эту отдачу в работающих мышцах? Какое свойство олигомерных белков обеспечивает этот эффект?
4. вычислите, какое количество О 2 (в %) отдает оксигенированный гемоглобин покоящейся и работающей мышце?
5. сделайте выводы о связи структуры белка с его функцией.
2. Количество освобождаемого гемоглобином кислорода в капиллярах зависит от интенсивности процессов катаболизма в тканях (эффект Бора). Как изменения метаболизма в тканях регулируют сродство НЬ к O 2 ? Влияние СО 2 и Н+ на сродство НЬ к О 2
 1. опишите эффект Бора.
1. опишите эффект Бора.
2. в каком направлении протекает процесс, представленный на схеме:
а) в капиллярах легких;
б) в капиллярах тканей?
3. в чем физиологическое значение эффекта Бора?
4. почему взаимодействие Нв с Н+ на участках, удаленных от гема, изменяет сродство белка к О 2 ?
3. Сродство НЬв к О 2 зависит от концентрации его лиганда - 2,3-бифосфо- глицерата, который является аллостерическим регулятором сродства Нв к О 2 . Почему взаимодействие лиганда в участке, удаленном от активного центра, влияет на функцию белка? Как 2,3-БФГ регулирует сродство НЬ к О 2 ? Для решения задачи ответьте на следующие вопросы:
1. где и из чего синтезируется 2.3-бифосфоглицерат (2,3-БФГ)? Напишите его формулу, укажите заряд данной молекулы.
2. с какой формой гемоглобина (окси или дезокси) взаимодействует БФГ и почему? В каком участке молекулы Нв происходит взаимодействие?
3. в каком направлении протекает процесс, представленный на схеме
а) в капиллярах тканей;
б) в капиллярах легких?
4. где должна быть более высокой концентрация комплекса
Нв-2,3-БФГ:
а) в капиллярах мышц, находящихся в состоянии покоя,
б) в капиллярах работающих мышц (при условии одинаковой концентрации БФГ в эритроцитах)?
5. как изменится сродство Нв к кислороду при адаптации человека к условиям высокогорья, если концентрация БФГ в эритроцитах при этом повышается? В чем физиологическое значение этого явления?
4. Разрушение 2,3-БФГ при хранении консервированной крови нарушает функции Нв. Как изменится сродство Нв к O 2 в консервированной крови, если концентрация 2,3-БФГ в эритроцитах может уменьшатся с 8 до 0,5 ммол/л. Можно ли переливать такую кровь тяжелобольным пациентам, если концентрация 2,3-БФГ восстанавливается не ранее чем через трое суток? Можно ли добавлением в кровь 2,3-БФГ восстановить функции эритроцитов?
5. Вспомните строение простейших молекул иммуноглобулинов. Какую роль играют иммуноглобулины в работе иммунной системы? Почему Ig часто называют бивалентами? Как структура Ig связана с их функцией? (Опишите на примере какого-либо класса иммуноглобулинов.)
Физико-химические свойства белков и методы их разделения.
6. Как суммарный заряд белка влияет на его растворимость?
а) определите суммарный заряд пептида при рН 7
Ала-Глу-Тре-Про-Асп-Лиз-Цис
б) как изменится заряд этого пептида при рН >7, рН <7, рН <<7?
в) что такое изоэлектрическая точка белка (ИЭТ) и в какой среде лежит
ИЭТ данного пептида?
г) при каком значении рН будет наблюдаться наименьшая растворимость данного пептида.
7. Почему кислое молоко в отличие от свежего при кипячении «сворачивается» (т.е. белок молока казеин выпадает в осадок)? В свежем молоке молекулы казеина имеют отрицательный заряд.
8. Для разделения индивидуальных белков используется метод гельфильтрации. Смесь, содержащую белки А, В, С с молекулярными массами, равными соответственно 160 000, 80 000 и 60 000, анализировали методом гель-фильтрации (рис. 1.35). Гранулы набухшего геля проницаемы для белков с молекулярной массой меньше 70 000. Какой принцип лежит в основе данного метода разделения? Какой из графиков правильно отражает результаты фракционирования? Укажите порядок выхода белков А, В и С с колонки.
 Рис. 1.35. Использование метода гель-фильтрации для разделения белков
Рис. 1.35. Использование метода гель-фильтрации для разделения белков
9. На рис. 1.36, А представлена схема электрофореза на бумаге белков сыворотки крови здорового человека. Относительные количества белковых фракций, полученных с помощью этого метода, составляют: альбумины 54-58%, α 1 -глобулины 6-7%, α 2 -глобулины 8-9%, β-глобулины 13%, γ-глобулины 11-12%.
 Рис. 1.36 Электрофорез на бумаге белков плазмы крови здорового человека (А) и больного (Б)
Рис. 1.36 Электрофорез на бумаге белков плазмы крови здорового человека (А) и больного (Б)
I - γ-глобулины; II - β-глобулины; III - α 2 -глобулин; IV - α 2 -глобулин; V - альбумины
Многие болезни сопровождаются количественными изменениями в составе сывороточных белков (диспротеинемии). Характер этих изменений учитывается при постановке диагноза и оценке тяжести и стадии заболевания.
С помощью данных, приведенных в табл. 1.5, сделайте предположение о заболевании, для которого характерен электрофоретический профиль, представленный на рис. 1.36.
Таблица 1.5. Изменение концентрации белков сыворотки крови при патологии
Белки - полимерные молекулы, в которых мономерами служат аминокислоты. В составе белков в организме человека встречают только 20 ?-аминокислот. Одни и те же аминокислоты присутствуют в различных по структуре и функциям белках. Индивидуальность белковых молекул определяется порядком чередования аминокислот в белке. Аминокислоты можно рассматривать как буквы алфавита, при помощи которых, как в слове, записывается информация. Слово несёт информацию, например о предмете или действии, а последовательность аминокислот в белке несёт информацию о построении пространственной структуры и функции данного белка.
Общая структурная особенность аминокислот - наличие амино- и карбоксильной групп, соединённых с одним и тем же?-углеродным атомом. R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к?-углеродному атому.
По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические (табл. 1-1).

Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. Пептидная связь образуется между а-карбоксильной группой одной аминокислоты и?-аминогруппой другой, т.е. является амидной связью. При этом происходит отщепление молекулы воды.
Пептидные цепи содержат десятки, сотни и тысячи аминокислотных остатков, соединённых прочными пептидными связями. За счёт внутримолекулярных взаимодействий белки образуют определённую гфостранственную структуру, называемую "конформация белков". Линейная последовательность аминокислот в белке содержит информацию о построении трёхмерной пространственной структуры. Различают 4 уровня структурной организации белков, называемых первичной, вторичной, третичной и четвертичной структурами (рис. 1-3). Существуют общие правила, по которым идёт формирование пространственных структур белков.
Аминокислотные остатки в пептидной цепи белков чередуются не случайным образом, а расположены в определённом порядке. Линейную последовательность аминокислотных остатков в полипептидной цепи называют "первичная структура белка". Линейные полипептидные цепи индивидуальных белков за счёт взаимодействия функциональных групп аминокислот приобретают определённую пространственную трёхмерную структуру, называемую"конформация" . Все молекулы индивидуальных белков (т.е. имеющих одинаковую первичную структуру) образуют в растворе одинаковую конформацию. Следовательно, вся информация, необходимая для формирования пространственных структур, находится в первичной структуре белков.
В белках различают 2 основных типа конформации полипептидных цепей: вторичную и третичную структуры.
1. Вторичная структура белков
Вторичная структура белков - пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов: ?-спираль и?-структура.
?-Спираль
В данном типе структуры пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали (рис. 1-5). На один виток?-спирали приходится 3,6 аминокислотных остатка.
В образовании водородных связей участвуют практически все атомы кислорода и водорода пептидных групп. В результате?-спираль "стягивается" множеством водородных связей. Несмотря на то, что данные связи относят к разряду слабых, их количество обеспечивает максимально возможную стабильность?-спирали. Так как все гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, гидрофильность (т.е. способность образовывать водородные связи с водой) ?-спиралей уменьшается, а их гидрофобность увеличивается.
Спиральная структура - наиболее устойчивая конформация пептидного остова, отвечающая минимуму свободной энергии. В результате образования?-спиралей полипептидная цепь укорачивается, но если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится.
Когда водородные связи образуются между атомами пептидного остова различных полипептидных цепей, их называют межцепочечными связями. Водородные связи, возникающие между линейными участками внутри одной полипептидной цепи, называют внутрицепочечными. В?-структурах водородные связи расположены перпендикулярно полипептидной цепи.
2. Третичная структура белков
Третичная структура белков - трёхмерная пространственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
Связи, участвующие в формировании третичной структуры белков
Гидрофобные взаимодействия
При укладке полипептидная цепь белка стремится принять энергетически выгодную форму, характеризующуюся минимумом свободной энергии. Поэтому гидрофобные радикалы аминокислот стремятся к объединению внутри глобулярной структуры растворимых в воде белков. Между ними возникают так называемые гидрофобные взаимодействия, а также силы ван дер Ваальса между близко прилегающими друг к другу атомами. В результате внутри белковой глобулы формируетсягидрофобное ядро. Гидрофильные группы пептидного остова при формировании вторичной структуры образуют множество водородных связей, благодаря чему исключается связывание с ними воды и разрушение внутренней, плотной структуры белка.
Ионные и водородные связи
Гидрофильные радикалы аминокислот стремятся образовать водородные связи с водой и поэтому в основном располагаются на поверхности белковой молекулы.
Все гидрофильные группы радикалов аминокислот, оказавшиеся внутри гидрофобного ядра, взаимодействуют друг с другом с помощью ионных и водородных связей (рис. 1-11).
Ионные связи могут возникать между отрицательно заряженными (анионными) карбоксильными группами радикалов аспарагиновой и глутаминовой кислот и положительно заряженными (катионными) группами радикалов лизина, аргинина или гистидина.
Водородные связи возникают между гидрофильными незаряженными группами (такими как -ОН, -CONH 2 , SH-группы) и любыми другими гидрофильными группами. Белки, функционирующие в неполярном (ли-пидном) окружении, например белки мембран, имеют обратное устройство: гидрофильные радикалы аминокислот расположены внутри белка, в то время как гидрофобные аминокислоты локализованы на поверхности молекулы и контактируют с неполярным окружением. В каждом случае радикалы аминокислот занимают наиболее выгодное биоэнергетическое положение.
Ковалентные связи
Третичную структуру некоторых белков стабилизируют дисульфидные связи, образующиеся за счёт взаимодействия SH-групп двух остатков цистеина. Эти два остатка цистеина могут находиться далеко друг от друга в линейной первичной структуре белка, но при формировании третичной структуры они сближаются и образуют прочное ковалентное связывание радикалов.
Четвертичная структура белков
Многие белки содержат в своём составе только одну полипептидную цепь. Такие белки называют мономерами. К мономерным относят и белки, состоящие из нескольких цепей, но соединённых ковалентно, например дисульфидными связями (поэтому инсулин следует рассматривать как мономерный белок).
В то же время существуют белки, состоящие из двух и более полипептидных цепей. После формирования трёхмерной структуры каждой полипептидной цепи они объединяются с помощью тех же слабых взаимодействий, которые участвовали в образовании третичной структуры: гидрофобных, ионных, водородных.
Количество и взаиморасположение полипептидных цепей в пространстве называют "четвертичная структура белков". Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным.
Все белки с одинаковой первичной структурой, находящиеся в одинаковых условиях, приобретают одинаковую, характерную для данного индивидуального белка конформацию, определяющую его специфическую функцию. Функционально активную конформацию белка называют "нативная структура".
При различных заболеваниях происходит изменение белкового состава тканей. Эти изменения называются протеинопатиями. Различают наследственные и приобретённые протеинопатии. Наследственные протеинопатии развиваются в результате повреждений в генетическом аппарате данного индивидуума. Какой-либо белок не синтезируется вовсе или синтезируется, но его первичная структура изменена. Примеры наследственных протеинопатии - гемоглобинопатии, рассмотренные выше. В зависимости от роли дефектного белка в жизнедеятельности организма, от степени нарушения конформации и функции белков, от гомо- или гетерозиготности индивидуума по этому белку наследственные протеинопатии могут вызывать болезни, протекающие с различной степенью тяжести, вплоть до летального исхода ещё до рождения или в первые месяцы после рождения.
полиморфизм белков - существование разных форм белка, выполняющих одинаковые или очень сходные функции (изобелки). Чаще всего изучают полиморфизм ферментов (т. е. наличие изофер-ментов), поскольку их гораздо легче обнаружить, чем другие белки, по катализируемой ими реакции.
2 .Физико-химические свойства белков
Индивидуальные белки различаются по своим физико-химическим свойствам: форме молекул, молекулярной массе, суммарному заряду
молекулы, соотношению полярных и неполярных групп на поверхности нативной молекулы белка, растворимости белков, а также степени устойчивости к воздействию денатурирующих агентов.
1. Различия белков по форме молекул
Как уже говорилось выше, по форме молекул белки делят на глобулярные и фибриллярные. Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки (исключение составляют мембранные белки).
2. Различия белков по молекулярной массе
Белки - высокомолекулярные соединения, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Д и выше. Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров (или субъединиц).
3. Суммарный заряд белков
Белки имеют в своём составе радикалы лизина, аргинина, гистидина, глутаминовой и аспарагиновой кислот, содержащие функциональные группы, способные к ионизации (ионогенные группы). Кроме того, на N- и С-концах полипептидных цепей имеются α-амино- и α-карбоксильная группы, также способные к ионизации. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apr и Гис.
Степень ионизации функциональных групп этих радикалов зависит от рН среды. При рН раствора около 7 все ионогенные группы белка находятся в ионизированном состоянии. В кислой среде увеличение концентрации протонов (Н+) приводит к подавлению диссоциации карбоксильных групп и уменьшению отрицательного заряда белков: -СОО - + Н + → -СООН. В щелочной среде связывание избытка ОН" с протонами, образующимися при диссоциации NH 3 + с образованием воды, приводит к уменьшению положительного заряда белков:
NH 3 + +ОН - → -NH 2 + H 2 O.
Значение рН, при котором белок приобретает суммарный нулевой заряд, называют "изоэлектрическая точка" и обозначают как pI. В изоэлектрической точке количество положительно и отрицательно заряженных групп белка одинаково, т.е. белок находится в изоэлектрическом состоянии.
Так как большинство белков в клетке имеет в своём составе больше анионогенных групп (-СОО -), то изоэлектрическая точка этих белков лежит в слабокислой среде. Изоэлектрическая точка белков, в составе которых преобладают катионогенные группы, находится в щелочной среде. Наиболее яркий пример таких внутриклеточных белков, содержащих много аргинина и лизина, - гистоны, входящие в состав хроматина.
Белки, имеющие суммарный положительный или отрицательный заряд, лучше растворимы, чем белки, находящиеся в изоэлектрической точке. Суммарный заряд увеличивает количество диполей воды, способных связываться с белковой молекулой, и препятствует контакту одноимённо заряженных молекул, в результате растворимость белков увеличивается. Заряженные белки могут двигаться в электрическом поле: анионные белки, имеющие отрицательный заряд, будут двигаться к положительно заряженному аноду (+), а катионные белки - к отрицательно заряженному катоду (-). Белки, находящиеся в изоэлектрическом состоянии, не перемещаются в электрическом поле.
4. Соотношение полярных и неполярных групп на поверхности нативных молекул белков
На поверхности большинства внутриклеточных белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков. Так, протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде.
Белки, или протеины, в живых организмах образуются в основном из 20 важнейших природных ос-аминокислот в результате реакции поликонденсации в присутствии ферментов. Молекулярные массы белков варьируют в очень широких пределах: от 10 000 до 1 000 000 и выше.
Остов белковой цепи построен из аминокислотных фрагментов, соединенных пептидной связью, и окружен разнообразными по химической природе заместителями. Пептидная связь в белках устойчива при 37°С в нейтральной среде, но в кислой или щелочной среде может гидролизоваться. В организме гидролиз белка осуществляется под действием ферментов пептидаз и строго контролируется.
В природных белках широко варьируются длина и состав цепи, что позволяет их молекулам даже в растворе принимать многообразные конформации.
Конформации макромолекулы белка в растворе представляют собой различные ее пространственные формы, возникающие в результате поворотов отдельных молекулярных фрагментов вокруг ординарных связей и стабилизирующиеся за счет межмолекулярных связей между отдельными группами данной макромолекулы или молекулами веществ, находящимися в окружающем растворе.
Взаимные переходы конформации в основном осуществляются без разрыва ковалентных связей в макромолекуле белка. При описании состава и конформации белка используют понятия первичная, вторичная, третичная и четвертичная структуры.
Первичная структура специфична для индивидуального белка и определяется составом и последовательностью аминокислотных остатков его цепи. При написании полных формул белков указывают порядок следования друг за другом аминокислотных остатков с помощью их трехбуквенных обозначений, начиная с N-конца цепи. Представление о первичной структуре миоглоби-на человека, содержащего в молекуле всего 153 аминокислотных остатка, дает следующая сокращенная запись:
Строго линейное расположение полипептидной цепи энергетически не выгодно, так как оно практически исключает взаимодействия между различными радикалами аминокислотных остатков. В результате именно таких взаимодействий возникают дополнительные связи, которые стабилизируют ту или иную конформацию белковой цепи в пространстве. Это происходит за счет следующих взаимодействий: ион-ионного взаимодействия; водородной связи; гидратации полярных групп; дисульфидной связи; взаимодействий Вандер-Ваальса между неполярными заместителями; гидрофобных взаимодействий, в результате которых выталкиваются молекулы воды из зоны взаимодействия неполярных заместителей между собой, а также донорно-акцепторной связи между ионом комплексообразователя и лигандными группами белка (рис. 21.3).
Вторичная структура белка характеризует форму полипептидной цепи, которая может быть спиралевидной (а-структура), складчатой (B-структура) или неупорядоченной (рис. 21.4). Основную роль в формировании и поддержании вторичной структуры

Рис. 21.3. Типы взаимодействий между заместителями аминокислотных остатков белковой молекулы и водной средой
Рис. 21.4. Вторичная структура белков: а - а-структура (спиралевидная), б - Р-структура (складчатая) играют водородные связи, возникающие между группами хребта полипептидной цепи.
Пространственное расположение а-структуры можно представить, вообразив, что полипептидная цепь обвивает цилиндр, а ее боковые радикалы направлены наружу. Витки спирали скреплены между собой за счет водородных связей между пептидными группами, расположенными на соседних витках спирали. И хотя энергия этих связей невелика, большое их число приводит к значительному энергетическому эффекту, в результате чего a-структура достаточно устойчива и жестка.
Складчатая (3-структура формируется из большого числа параллельных вытянутых полипептидных цепей, связанных множеством водородных связей между собой. Боковые радикалы R располагаются выше и ниже плоскости, проведенной через образовавшийся складчатый лист.
Неупорядоченная структура отдельных фрагментов белка характеризуется отсутствием пространственной упорядоченности в их расположении.
Какая вторичная структура белка реализуется - зависит от его аминокислотного состава, т. е. от первичной структуры. Для большинства природных белков характерно сосуществование в одной молекуле фрагментов с а-, р- и неупорядоченной структурой.
Невысокая прочность водородных связей позволяет сравнительно легко трансформировать вторичную структуру под внешним воздействием: изменением температуры, состава или рН среды - или под механическим воздействием. В результате трансформации вторичной структуры белка меняются его нативные, т. е. первичные от природы, свойства, а следовательно, его биологические и физиологические функции.
Третичная структура белка определяет общее расположение его полипептидной цепи в пространстве. Полагают, что в формировании и стабилизации третичной структуры белковой молекулы решающая роль принадлежит взаимодействию боковых заместителей аминокислот, которые сближаются в пространстве за счет изгибов полипептидной цепи. Виды этих взаимодействий были показаны на рис. 21.3.
Третичная структура белковой молекулы возникает совершенно автоматически в результате самоорганизации полипептидной цепи в соответствии с ее первичной и вторичной структурами, а также с составом окружающего раствора. Движущей силой, свертывающей полипептидную цепь белка в строго определенное трехмерное образование, является взаимодействие аминокислотных радикалов между собой и с молекулами окружающего раствора. При этом в водных растворах гидрофобные заместители вталкиваются внутрь белковой молекулы, образуя там сухие зоны ("жирные капли"), а гидрофильные - ориентируются в сторону водной среды. В некоторый момент достигается энергетически выгодная конформация молекулы для водной среды, и такая конформация белковой молекулы стабилизируется. При этом энтропия полипептидной цепи уменьшается, а энтропия системы в целом (полипептидная цепь + водная среда) остается постоянной или возрастает. Таким образом, с позиции II закона термодинамики стабилизацию третичной структуры белка в водной среде обеспечивает стремление водного окружения молекулы белка перейти в состояние с максимальной энтропией. Представление о третичной структуре молекул белков миоглобина и лизоцима дает рис. 21.5. На рисунке заштрихованный диск в молекуле миоглобина - это гем, содержащий порфириновый лиганд и комплексообразователь катион Fe 2+ . В молекуле лизоцима показаны S-S дисульфидные мостики, участвующие в стабилизации третичной структуры этого белка.

Рис. 21.5. Третичные структуры: миоглобина (а) и лизоцима (б)
Третичная структура белка, по сравнению с его вторичной структурой, еще более чувствительна к внешним воздействиям. Поэтому действие слабых окислителей, смена растворителей, изменения ионной силы, рН среды и температуры нарушают третичную структуру белков, а следовательно, и их нативные свойства.
Четвертичная структура. Крупные молекулы белка с молекулярной массой более 60 000 обычно представляют собой агрегаты, которые состоят из нескольких полипептидных цепей со сравнительно небольшой молекулярной массой. При этом каждая цепь, сохраняя характерную для нее первичную, вторичную и третичную структуру, выступает в роли субъединицы этого агрегата, имеющего более высокий уровень пространственной организации - четвертичную структуру. Такая молекулаагрегат представляет единое целое и выполняет биологическую функцию, не свойственную отдельно взятым субъединицам. Например, молекула гемоглобина состоит из 4 субъединиц и для нее характерна значительно большая лабильность комплекса с кислородом, чем для отдельных ее субъединиц, что проявляется в свойствах миоглобина (разд. 10.4). Четвертичная структура белка закрепляется в основном за счет водородных связей и вандерваальсовых взаимодействий, а иногда и дисульфидных связей между объединяемыми полипептидными цепями. Молекулярная масса белков с четвертичной структурой может достигать нескольких десятков миллионов. Четвертичная структура белков чувствительна к внешним воздействиям и может ими нарушаться.
Форма белковых молекул. По форме молекулы нативные белки, т. е. проявляющие запрограммированные природой биологические свойства, делят на фибриллярные и глобулярные. Молекулы фибриллярных белков обычно имеют B-структуру и волокнистое строение; они не растворяются в воде, так как на их поверхности много гидрофобных радикалов. Фибриллярными белками являются фиброны белка; кератин волос, кожи, ногтей; коллаген сухожилий и костной ткани; миозин мышечной ткани.
Глобулярные белки имеют цилиндрическую или сферическую форму и размер 10 -9 -10 -7 м. Они обычно растворяются в воде, так как на их поверхности в основном находятся полярные группы. Растворяясь в воде, глобулярные белки образуют лиофильные коллоидные растворы (разд. 27.3). Примеры глобулярных белков: альбумин (яичный белок), миоглобин, почти все ферменты.
Жидкокристаллическое состояние. Молекулы белков - достаточно крупные образования и имеют фиксированную пространственную структуру, которая может быть анизотропна в целом, или могут быть анизотропны отдельные фрагменты пептидной цепи. Поэтому для многих белков характерно жидкокристаллическое состояние в определенном температурном интервале (термотропное жидкокристаллическое состояние) или образование одного или нескольких лиотропных жидкокристаллических со стояний с участием водной среды при определенной концентрации веществ в растворе. Образование жидкокристаллического состояния или переходы из одного жидкокристаллического состояния в другое, сопровождаемые изменением ориентации отдельных фрагментов молекулы белка или изменением в согласованности движения в системе, не требуют больших энергетических затрат, но могут привести к изменению его биологических функций. Например, повлиять на сократительную функцию миозина мышечных волокон, ферментативную активность, транспортную функцию белков или их защитные свойства относительно коллоидных систем. Так, при определенных условиях молекулы гемоглобина переходят в жидкокристаллическое состояние. Это приводит к ряду патологических нарушений, проявляющихся в потере эластичности эритроцитами. В результате они закупоривают капилляры, и транспорт кислорода нарушается. Образование камней в моче- или желчевыводящих системах связано с изменением не только концентрации, но и состояния защитных белков в этих системах. Способность белков и их растворов переходить в жидкокристаллическое состояние до последнего времени в биологии, биохимии и медицине практически не рассматривалась, несмотря на чрезвычайную важность этих свойств с позиции жизнедеятельности любых живых систем.
Денатурация. Пространственная структура белков, как уже указывалось, может нарушаться под влиянием ряда факторов: повышение температуры, изменение рН и ионной силы среды, облучение УФ и рентгеновскими лучами, присутствие веществ, способных дегидратировать молекулу белка (этанол, ацетон, мочевина) или вступать во взаимодействие с его заместителями (окислители, восстановители, формальдегид, фенол) и даже при сильном механическом перемешивании растворов.
Денатурацией называется разрушение природной (нативной) конформации макромолекулы белка под внешним воздействием.
При денатурации разрушаются четвертичная, третичная и вторичная структуры, а первичная структура белка сохраняется. Поэтому денатурация может иметь обратимый (денатурация -ренатурация) и необратимый характер в зависимости от природы белка и интенсивности внешнего воздействия. Необратимая денатурация обычно происходит при тепловом воздействии (например, свертывание яичного альбумина при варке яиц). У денатурированных глобулярных белков уменьшается сродство к воде, так как на поверхности молекул оказывается много гидрофобных радикалов. Поэтому снижается их растворимость, появляются хлопья или осадок. Главное, при денатурации утрачивается биологическая активность и глобулярных, и фибриллярных белков, что наблюдается при многих способах их выделения (разд. 11.3). Во избежание денатурации белка и для сохранения его нативной конформации в процессе выделния все операции проводят в мягких условиях при температуре не выше 5°С, избегая резких воздействий химических реагентов.
Поверхностные свойства белков. Молекулы белков содержат разные ос-аминокислоты, имеющие и гидрофобные радикалы на основе алифатических и ароматических углеводородов, и гидрофильные радикалы, включая пептидную группировку. Эти радикалы распределены по всей цепи, и поэтому большинство белков является поверхностно-активными веществами (разд. 26.6). Характерная особенность белковых ПАВ - наличие в их молекулах фрагментов с резко различным гидрофильно-липофильным балансом, что делает их эффективными стабилизаторами для лиофобных дисперсных систем, эмульгаторами жиров и холестерина и активными компонентами биологических мембран.
Благодаря поверхностно-активным свойствам некоторые белки образуют лиофильные мицеллы (разд. 27.3) с липидами (включая холестерин и его эфиры), называемые липопротеинами. В липопротеинах между молекулами белков и липидов нет ковалентных связей, а есть только межмолекулярные взаимодействия. Внешняя поверхность липопротеиновой мицеллы состоит из гидрофильных фрагментов белков и молекул фосфо-липидов, а ее внутренняя часть (ядро) представляет собой гидрофобную среду, в которой растворены жиры, холестерин и его эфиры (рис. 21.6). Наличие в липопротеинах внешней гидрофильной оболочки делает эти богатые липидами мицеллы "растворимыми" в воде и хорошо приспособленными для транспорта жиров из тонкого кишечника в жировые депо и в различные ткани. Диаметр липопротеиновых мицелл составляет от 7 до 1000 нм.
В зависимости от плотности, размеров мицелл и соотношения в них белка и липидов липопротеины подразделяют на 4 класса (табл. 21.2).

Рис. 21.6. Мицелла липопротеина
Роль хиломикронов и липопротеинов очень низкой плотности заключается в транспорте жиров и их гидролизе под действием липопротеинлипазы. По мере расщепления жиров происходит превращение:
Р-Липопротеины в основном транспортируют холестерин в клетки, а а-липопротеины выводят из клеток избыток холестерина.
При изучении липопротеинового состава сыворотки крови установлено, что чем больше отношение B-липопротеины/а-липо-протеины, тем больше опасность обильных отложений холестерина на внутренней поверхности кровеносных сосудов, т. е. атеросклероза. Атеросклероз способствует развитию инсульта или инфаркта миокарда за счет ограничения кровотока через суженные сосуды мозга или сердца.
Поверхностные свойства белков, характеризующие их способность к межмолекулярным взаимодействиям, лежат в основе взаимодействия фермента с субстратом (разд. 5.6), антитела с антигеном и объясняют различные взаимодействия, называемые в биологии специфической комплементарностью (теория "ключа и замка"). Во всех этих случаях имеет место строгое соответствие между поверхностной структурой и свойствами взаимодействующих частиц, которые обеспечивают высокую эффективность различных видов межмолекулярных взаимодействий между ними (рис. 21.3). В биологии это часто упрощенно отражают, используя графическое соответствие форм и размеров взаимодействующих частиц (рис. 21.7).
Информационные свойства белков. Молекулы белков и отдельные их фрагменты рассматриваются как носители биологической
Рис. 21.7. Графическая интерпретация соответствия межмолекулярных взаимодействий между белковыми частицами, описываемых специфической комплементарностью или теорией "ключа и замка"
информации, в которой роль букв алфавита играют 20 аминокислотных остатков. В основе считывания этой информации находятся различные виды межмолекулярных взаимодействий и стремление системы использовать их эффективно. Например, в ферментах вблизи активного центра часть белковой молекулы содержит определенные аминокислотные остатки, заместители которых сориентированы в пространстве так, чтобы происходило узнавание строго определенного субстрата, с которым реагирует данный фермент. Аналогично протекает взаимодействие антитело - антиген или происходит синтез в организме соответствующего антитела на появившийся антиген. Информационные свойства белков лежат в основе иммунитета, представляющего собой целостную систему биологических механизмов самозащиты организма, в основе которых лежат информационные процессы распознавания "свой" и "чужой". "Аминокислотный язык", содержащий 20 единиц, является одним из наиболее оптимальных и надежных способов кодирования важной информации для жизнедеятельности живых систем, включающей сведения о форме отдельных органов и организма в целом.
Кислотно-основные свойства. Белки, как и а-аминокислоты (разд. 8.2), являются полиамфолитами, проявляя кислотные свойства за счет неионизованных карбоксильных групп -СООН, аммонийных групп тиольных групп -SH, а также n-гидрокси-
фенильных групп Основные свойства белки проявляют за счет групп - СОО-, аминогрупп - NH 2 , а также заместителей имидазола -C 3 H 3 N 2 и гуанидина -(CH 5 N 3) + . В водных растворах в зависимости от рН среды белки могут находиться при рН = рI белка в молекулярной, т. е. нейтральной форме, имеющей биполярно-ионное строение, при рН < рI белка появляется катионная форма, и при рН > рI белка появляется анионная форма, в основном за счет ионизации заместителей (-RH).

В сильнокислой среде происходит протонирование ионизованной карбоксильной группы белка, а в сильнощелочной среде - депротонирование концевой аммонийной группы. Однако в биологических средах, для которых не характерны такие крайние значения рН, подобных превращений с белковыми молекулами не происходит. Кислотно-основные превращения в молекулах белков, естественно, сопровождаются изменением их конформации, а следовательно, биологические и физиологические функции катиона или аниона белков будут отличаться не только друг от друга, но и от функций их молекул.
В зависимости от аминокислотного состава белки подразделяются на "нейтральные" (рI = 5,0 - 7,0), "кислотные" (рI < 4,0) и "основные", или "щелочные" (рI > 7,5) (табл. 21.3). В кислотных белках повышенное содержание аспарагиновой или глутаминовой кислот, а в "основных" - аргинина, лизина или гистидина. На основе белков в организме действуют белковые буферные системы (разд. 8.4).

Различие в кислотно-основных свойствах белков лежит в основе разделения и анализа белковых смесей методами электрофореза и ионообменной хроматографии. В постоянном электрическом поле белки обладают электрофоретической подвижностью, причем направление их движения к катоду или аноду зависит от значения рН раствора и рI белка. При рН < рI белок частично находится в форме катиона и перемещается к катоду. При рН > рI белок перемещается к аноду, поскольку частично находится в форме аниона. При рН = рI белок полностью находится в молекулярной форме и под действием электрического поля не перемещается. Электрофо-ретическая подвижность иона белка зависит от его размера и заряда, а также от рН раствора. Подвижность иона будет тем больше, чем больше разница между рН раствора и рI белка. Анализ белка с помощью электрофореза широко применяется в клинической биохимии для диагностики заболеваний.
Комплексообразующие свойства. Белки - активные полидентатные лиганды (разд. 10.1), особенно содержащие мягкие функциональные группы: тиольную, имидазольную, гуанидиновую, аминогруппу:

Вследствие наличия в молекулах белков различных функциональных групп они образуют комплексные соединения разной устойчивости в зависимости от поляризуемости иона комплексо-образователя. С малополяризуемыми (жесткими) катионами К + и Na + белки образуют малоустойчивые комплексы, которые в организме выполняют роль ионофоров для катионов или активаторов белков как субстратов для тех или иных биохимических процессов. С менее жесткими катионами Mg 2+ или Са 2+ белки образуют достаточно прочные комплексы. С катионами d-металлов: железа, меди, марганца, цинка, кобальта, молибдена ("металлы жизни"), достаточно поляризуемыми, т. е. мягкими, белки образуют прочные комплексы. Однако особенно прочные комплексы они образуют с катионами металлов-токсикантов: свинца, кадмия, ртути и другими, проявляющими высокую поляризуемость, т. е. очень мягкими. Прочные комплексы белков с катионами металлов часто называют металлопротеинами.
Множество ферментов представляют собой хелатные комплексы белка с катионом какого -либо "металла жизни". При этом именно катион комплексообразователя под влиянием белкалиганда является активным центром фермента, а фрагмент белковой молекулы вблизи этого центра обычно выполняет роль опо-знавателя и активатора субстрата. Белковый компонент метал-лофермента часто называют апоферментом.
Все белки при обработке солями меди в щелочной среде образуют хелатный комплекс фиолетового цвета, что является качественной реакцией на белки, которая называется биуретовой реакцией:
Эта реакция происходит путем депротонирования пептидных групп белка, чему способствуют щелочная среда и наличие в ней иона комплексообразователя.
Электрофильно-нуклеофильные реакции. К этим реакциям прежде всего относится гидролиз белков - основной путь их катаболизма (распада) в организме. При гидролизе белка реагент -молекула воды - выступает и как нуклеофил за счет ОН", и как электрофил за счет Н + . Нуклеофильная частица ОН" атакует электрофильный центр пептидной связи, т. е. углеродный атом карбонильной группы, а нуклеофильный центр этой связи - атом азота - атакуется электрофилом - протоном. В результате атаки молекулами воды пептидные связи в белках разрываются, и образуются вначале осаминокислоты и пептиды, а конечными продуктами являются ос-аминокислоты.
Гидролитический распад белков протекает в любой клетке организма, точнее, в ее липосомах, где сосредоточены гидролитические ферменты. Гидролиз белков может быть частичным (до пептидов) и полным (до аминокислот). Частичный гидролиз ускоряется протеиназами, которые способствуют образованию пептидов. Полученные пептиды гидролизуются до аминокислот при участии пептидаз. В организме гидролиз белков осуществляется в основном целым набором ферментов, каждый из которых расщепляет ту пептидную связь, которая образована определенными аминокислотами. Так, карбоксипептидаза специфически отщепляет от белков С-концевую аминокислоту, трипсин гидролизует пептидную связь между аминокислотами с неполярным (гидрофобным) заместителем. Химотрипсин расщепляет пептидную связь, образованную фенилал анином, тирозином, триптофаном с другими аминокислотами. В организме пищевые белки расщепляются полностью, поскольку для жизнедеятельности используются в основном свободные ос-аминокислоты.
В лабораторных условиях белки гидролизуются как в кислой, так и в щелочной среде. Однако щелочной гидролиз практически не используется из-за неустойчивости многих осаминокислот в этих условиях. Обычно полный гидролиз проводят при нагревании белка до 110°С в запаянной ампуле с 20 % НС1 в течение 24 ч. В этих условиях гидролиз белка протекает до конца, но образующийся триптофан при этом полностью разлагается. Поэтому предпочтение отдают ферментативному гидролизу.
Белки организма, содержащие аспарагиновую и глутамино-вую кислоты, могут выступать акцептором аммиака, который как нуклеофил реагирует по свободным карбоксильным группам заместителя, т. е. происходит реакция амидирования белков:
Реакция амидирования - эндэргоническая, поэтому в организме она сопряжена с реакцией гидролиза АТФ.
С целью стерилизации объектов (полного освобождения от микроорганизмов) их обрабатывают формальдегидом. Формальдегид как активный электрофил реагирует по свободным аминогруппам белков, образуя их метилольные производные:
В результате этой реакции белок теряет свои нативные свойства, так как происходит его необратимая денатурация.
Активные электрофильные реагенты (ЕХ): 2,4-динитрофтор-бензол, фенилизотиоцианат или дансилхлорид - используются для установления первичной структуры белков или пептидов. Они в присутствии оснований реагируют по N-концевой аминокислоте аниона белка и способствуют ее отщеплению в виде соответствующего производного Е-NH-CRH-СООН, легко идентифицируемого или хроматографически, или спектрально:
Оставшаяся часть белка при этом не разрушается, а операции по отщеплению следующей аминокислоты можно повторять. Эти реакции лежат в основе работы автоматического анализатора первичной структуры белков. Обычно анализируемый белок вначале подвергают частичному гидролизу с получением нескольких пептидов. Полученные пептиды разделяют, очищают, и в каждом определяется последовательность аминокислот, а затем составляется первичная структура анализируемого белка.
Окислительно-восстановительные свойства. Белки относительно устойчивы к мягкому окислению, за исключением содержащих аминокислоту цистеин, так как тиольная группа последней легко окисляется в дисульфидную группу, причем процесс может носить обратимый характер:
В результате этих превращений происходит изменение конформации белка и его нативных свойств. Поэтому серосодержащие белки чувствительны к свободнорадикальному окислению или восстановлению, что происходит при воздействии на организм радиации или токсичных форм кислорода (разд. 9.3.9).
Тиол-дисульфидные превращения белка кератина лежат в основе химической завивки волос, так как цистеин и цистин входят в его состав. Сначала волосы обрабатывают восстановителем, чтобы разрушить связи -S-S- цистина и превратить в тиольные группы цистеина. Затем волосы укладывают в локоны (завивают) и обрабатывают окислителем. При этом образуются дисульфидные связи цистина, которые помогают волосам сохранить их новую форму.
При более жестком окислении тиольная группа белков окисляется в сульфогруппу практически необратимо:
Жесткое окисление белков до СО2, H2O и аммонийных солей используется организмом для устранения ненужных белков и пополнения своих энергетических ресурсов (16,5 - 17,2 кДж/г).
В организме белки, содержащие остатки лизина, пролина, фе-нилаланина и триптофана, подвергаются ферментативному гидроксилированию (монооксигеназное окисление) при участии кислорода и восстановленной формы кофермента:


В результате реакции гидроксилирования усиливаются гидрофильные свойства белка и его способность к образованию водородных связей. Это имеет место у тропоколлагена, у которого три цепи объединяются в устойчивую суперспираль за счет водородных связей, в образовании которых участвуют и гидроксипролиновые остатки.
Подобная реакция происходит в молекуле тропоколлагена, что приводит к еще более прочной "сшивке" его пептидных цепей.
Окислительное дезаминирование белков под действием нингидрина, сопровождаемое образованием синего окрашивания, -характерная качественная реакция на белки - нингидриновая реакция (см. разд. 21.2.4).
Для обнаружения белков, содержащих ароматические и гетероциклические аминокислоты, используется ксантопротеиновая реакция, которая при действии концентрированной азотной кислоты сопровождается появлением желтого окрашивания, переходящего при добавлении щелочи или аммиака в оранжевое:

Именно в результате ксантопротеиновой реакции наблюдается желтое окрашивание кожи при попадании на нее концентрированной азотной кислоты.
Таким образом, для белков характерны: определенная конформация, жидкокристаллическое состояние, поверхностно-активные и информационные свойства, а также все четыре вида химических реакций: кислотно-основные, комплексообразующие, электрофильно-нуклеофильные и окислительно-восстановительные, лежащие в основе жизнедеятельности любых живых систем. Совокупность всех этих свойств объясняет уникальность белков для всего живого мира.
Cтраница 1
Трехмерная структура белка еще ие известна.
Трехмерная структура белка определяется невалентными взаимодействиями между аминокислотными остатками цепи, а также между этими остатками и растворителем (гл.
Трехмерная структура белка высокослецифична. Иными словами, полипептидная цепь или цепи не просто свертываются с образованием структуры, близкой к сферической; свертывание проходит ряд строго фиксированных этапов, в результате чего возникает уникальная или почти уникальная конфигурация. Ввиду большой сложности и высокой специфичности третичной структуры, естественно, очень важно, во-первых, изучить тонкие детали этой структуры и, во-вторых, попытаться понять природу сил, ответственных за ее поддержание. Данные по вязкости, коэффициенту трения и светорассеянию дают информацию относительно общей топографии макромолекул. Более точные сведения, касающиеся деталей третичной структуры белков, удается получить с помощью рентгеноструктурного анализа.
Для выяснения трехмерной структуры белков в последнее время успешно применяются также методы низкотемпературной вычислительной техники, а также математические и компьютерные методы определения объемной структуры на основании данных последовательностей аминокислот.
Существенную помощь в подобных случаях оказывает знание трехмерной структуры белков. Имеющиеся в настоящее время данные показывают, что обычно остатки, находящиеся во внутренней части белка, мало подвержены изменениям и что все различия между гомологичными белками (замены аминокислот, делеции или вставки петель в цепи) касаются поверхности молекул. Таким образом, последовательности отдаленно родственных белков можно сопоставлять по остаткам, которые занимают геометрически сходные позиции в пространственной структуре.
В природе дисульфидные мостики имеют важное значение, определяя трехмерную структуру белков (разд.
Проведенный им анализ дифракционной картины волокон кератина привел к простому представлению о трехмерной структуре белков, образованных в результате упаковки вытянутых ф-кератин) или изогнутых (а-кератин) полипептидных цепей. В основе этого представления лежало два принципиальных положения: о возможности существования изогнутых форм полипептидных цепей, которые считались полностью растянутыми, и о существовании упорядоченной трехмерной структуры белков, составляющей основу упаковки.
Характерной особенностью современных работ по конформа-ционному анализу полипептидов является расчет предпочтительной конформации с использованием трехмерных структур белков, установленных ранее с помощью рентгеноструктурного анализа, что позволяет проверить правильность расчета. Полученные результаты существенно разнятся по достоверности ввиду неопределенностей, связанных с установлением минимума энергии конформации молекулы, как это показано на примере полипептидов.
Такие деформации, безусловно, могут иметь место в силу взаимодействия между субстратом и трехмерной структурой белка и, поскольку последний не является жестким образованием, его структура также будет деформироваться. Деформации стабильных структур основного состояния приводят к тому, что такого рода взаимодействия осуществляются с затратой энергии и понижают общую энергию связывания.
Наконец, мы рассмотрим молекулярные основы самовоспроизведения клеток и преобразования одномерной информации, содержащейся в ДНК, в трехмерную структуру белков. По ходу дела мы увидим, что биохимия способствует формированию новых важных представлений, касающихся физиологии человека, проблем питания и медицины, более глубокому пониманию биологии растений, основ сельского хозяйства, эволюции, экологии, а также великого круговорота вещества и энергии между солнцем, землей, растениями и животными.
Ти представляет собой лабильный трехдоменный белок с молеку - Цфной массой около 45 000 дальтон. Трехмерная структура белка находится в адии интенсивного исследования.
Каждому белку свойственна своя особая геометрическая форма, или конформация. Для описания трехмерной структуры белков рассматривают обычно четыре уровня организации, которые мы здесь и опишем.
Как известно, не все белки содержат цистин; однако имеются и другие возможности сшивки цепей, например при помощи фосфо-эфирных связей. Кроме того, следует иметь в виду, что трехмерная структура белка, несомненно, приводит к взаимодействию боковых цепей аминокислот друг с другом или с какими-либо участками пептидной цепи. Важную роль в образовании уникальной структуры белка, обеспечивающей его биологическую функцию, играют прочно связанные с ним вещества небелковой природы, такие, как металлы, пигменты и сахара. Молекула гемоглобина человека состоит из четырех пептидных цепей (двух а - и двух (З - цепей), соединенных с четырьмя геминовыми группами, которые и являются переносчиками кислорода. Структуры обеих цепей гемоглобина (по Брауницеру и др. ) и миоглобина приведены на фиг. Интересно, что, согласно недавно опубликованной структуре субъединицы белка вируса табачной мозаики , в цепи из 158 аминокислотных остатков отсутствуют поперечные связи (фиг.
